Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase
Artículo seleccionado
Bleecker ER, FitzGerald JM, Chanez P, Papi A, Weinstein SF, Barker P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet2016(2)
Revisor
Juan Luis García Rivero
Servicio de Neumología del Hospital de Laredo, Laredo (Cantabria), España.
Tema: Tratamiento del asma grave con benralizumab, un anticuerpo antireceptor-IL5.
Palabras clave: benralizumab, anticuerpo monoclonal antireceptor de la interleucina-5, asma grave eosinofílica.
Resumen
Benralizumab es un anticuerpo monoclonal humanizadocontra el receptor α de la interleucina-5 que induce la destrucción directa, rápida y casi completa de los eosinófilos a través de la citotoxicidad mediada por células dependientes de anticuerpos, proceso por el cual las célulasnatural killer(NK) causan la apoptosis de los eosinófilos.
Para muchos pacientes, la eosinofilia es un sello de gravedad que se asocia a una mayor frecuencia de las agudizaciones del asma, una mayor carga de síntomas y un mayor deterioro de la función pulmonar. Por contra, mantener un número reducido de eosinófilos en sangre se ha relacionado con un menor número de agudizaciones de asma y un menor número de ingresos hospitalarios. La citoquina interleuquina 5 es un motor principal enla proliferación, maduración, activación y supervivencia de los eosinófilos.
Hasta la fecha, son varios los ensayos clínicos publicados sobre terapias dirigidas a disminuir el número de eosinófilos, incluidos dos estudios de fase 1 con benralizumab, que mostraron una reducción del número de eosinófilos en sangre en pacientes con atopia leve y asma eosinofílica, así como unestudio fase 2b también conbenralizumab que reportó una disminución de la tasa de agudizaciones en los pacientes con asma grave eosinofílica. La eficacia parecía mostrar mejores resultados en los pacientes con recuentos de eosinófilos en sangre superiores a 300 células por microlitro. Dos estudios fase 3 y un análisis secundario posterior de datos de fase 3 con mepolizumab, así como un informe duplicado de estudios fase 3 de tratamiento con reslizumab en pacientes con asma grave no controlada reforzaron la idea del beneficio clínico de las terapias dirigidas a la interleucina-5 para los pacientes con asma grave de perfil eosinofílico.
Recientemente se han publicado dos ensayos clínicos fase 3, con idéntico diseño pero realizados en diferentes países, cuyo objetivo ha sido investigar la eficacia y la seguridad del benralizumaben pacientes con asma grave no controlada a pesar de dosis altas de corticosteroides inhalados, más LABA en pacientes con un recuento de eosinófilos de 300 células por microlitro o mayor(1,2).
De los dos estudios, el SIROCCO se llevó a cabo, entre otros países, en España, por lo que me referiré a éste a partir de ahora.
Este estudio incluyó a pacientes de 12-75 años con asma grave no controlada a pesar de dosis media-alta de corticosteroides inhalados (ICS) más β₂-agonistas de acción prolongada (LABA) y una historia de dos o más agudizaciones en el año previo. Como criterios de inclusión, los pacientes debían tenerun FEV1 pre-broncodilatador menor del 80% del predicho (<90% del valor esperado para los pacientes de 12-17 años),un cuestionario de Control del Asma-6 (ACQ-6) ≥1,5,una reversibilidad del FEV1 postbroncodilatador del 12% o mayor y 200 ml o más en el FEV1 en los 12 meses previos a la inclusión en el estudio.
Los pacientes fueron asignados aleatoriamente (1: 1: 1) para recibir durante 56 semanas benralizumab 30 mg cada 4 semanas (Q4W), benralizumab 30 mg cada 8 semanas (Q8W; las primeras tres dosis con 4 semanas de diferencia) o placebo (todos inyección subcutánea). Los pacientes fueron divididos (2: 1) en base al recuento de eosinófilos en sangre, 300 células por microlitro o mayor y menos de 300 células por microlitro, respectivamente. El objetivo principal del estudio fue examinar la tasa de agudizaciones a lo largo del estudioen los pacientes que recibieron dosis altas de ICS-LABAy presentaban un recuento de eosinófilos en sangre de 300 células por microlitro o mayor (análisis por intención de tratar) en comparación con placebo. Como objetivos secundarios, se incluyeron el tiempo hasta la primera agudización del asma, la tasa anual de agudizaciones que se asociaron con una visita a un servicio de urgencias o un ingreso hospitalario, el FEV1 postbroncodilatador, la puntuación del ACQ-6, la puntuación del AQLQ y la puntuación total de los síntomas del asma.
Fueron aleatorizados y asignados a recibir tratamiento 1.205 pacientes, de los cuales
407 recibieron placebo, 400 benralizumab 30 mg Q4W y 398 benralizumab Q8W.
Las características basales de los pacientes fueron similares en los tres grupos de tratamiento, así como entre los pacientes con eosinofilia mayor o menor de 300 células por microlitro.
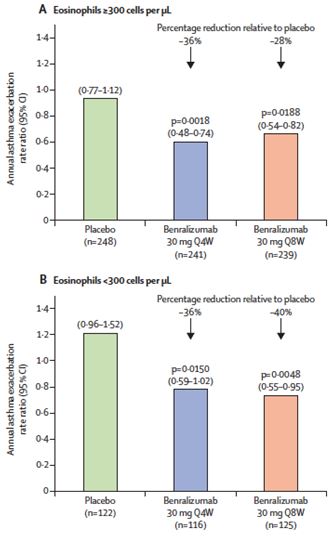
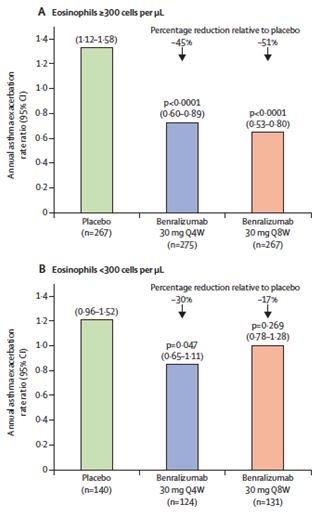
Ambas dosis de tratamiento alcanzaron el objetivo principal y redujeron significativamente el riesgo de agudizaciones comparado con placebo en la semana 48 en el grupo de pacientes con eosinófilos mayor de 300 células por microlitro.
La pauta de tratamiento de 4 semanas de benralizumab redujo el riesgo de agudizaciones un 45% respecto a placebo (0,55; 95% CI 0,42–0,71; p<0,0001), mientras que la pauta de 8 semanas alcanzó una reducción del 51% (0,49; 0,37–0,64; p<0,0001).
Ambas dosis mejoraron de manera significativa el FEV1 prebroncodilatador comparado con placebo en la semana 48. La diferencia de cambio respecto al basal fue de 106 ml para la pauta de 4 semanas (95% CI 0,016–0,196; p=0,0215) y de 159 ml para la pauta de 8 semanas (0,068–0,249; p=0,0006). La rama de tratamiento de 8 semanas mejoró también los síntomas de asma, como indica el descenso en el score de síntomas en la semana 48 comparado con placebo (least-squares mean difference –0,25, 95% CI –0,45 to –0,06; p=0,0118), sin embargo en esta variable, la pauta de 4 semanas no mostró diferencias significativas respecto a placebo (–0,08, –0,27 to 0,12; p=0,4420).
En cuanto a las agudizaciones que requirieron atención en urgencias o ingreso hospitalario, también fue la pauta de 8 semanas la que mostró diferencias significativas respecto a placebo (rate ratio 0,37, 95% CI 0,20–0,67; p=0,0010). Lo mismo ocurrió con los cuestionarios ACQ-6 (least-squares mean difference –0,29, 95% CI –0,48 to –0,10; p=0,0028) y AQLQ (0,30; 0,10–0,50; p=0,0036).
Los pacientes que tenían menos de 300 eosinófilos por microlitro en sangre periférica mostraron una reducción de las agudizaciones en el grupo de tratamiento de 4 semanas (p = 0,0471), y los que recibieron la dosis 8 semanastuvieron mejoras en los síntomas de asma (p = 0,0431). Sin embargo, hay que tener en cuenta que este estudio no fue diseñado para detectar diferencias dentro de este grupo.
Los eventos adversos más comunes en los pacientes tratados con benralizumab fueron el empeoramiento del asma (105 [13%]), la nasofaringitis (93 [12%]) y las infecciones del tracto respiratorio superior (76 [10%]); mientras que los eventos adversos relacionados con el empeoramiento del asma fueron reportados proporcionalmente por menos pacientes en los grupos de benralizumab que en el grupo placebo.
Los eventos adversos graves fueron reportados en un porcentaje similar de pacientes con benralizumab (99 [12%]) o con placebo (55 [14%]).
Conclusiones
Los resultados de estos dos ensayos clínicosdemuestran que el anticuerpo antireceptor de la IL-5, benralizumab, reduce significativamente la tasa anual de agudizaciones, hasta un 51% después de 48 semanas de tratamiento en pacientes con asma grave no controlada y con eosinofilia (recuento de eosinófilos en sangre periférica ≥ 300 células por microlitro). El benralizumab también mejora significativamente la función pulmonar, con incrementos de hasta 159 ml en el FEV1prebroncodilatador, en relación con el placebo. Dependiendo del régimen de dosificación, existen diferencias respecto a placebo, siendo generalmente mejores para la cohorte de 8 semanas que para la de 4 semanas de tratamiento, especialmente para los síntomas reportados por el paciente.Estos hallazgos sugieren que el beneficioclínico obtenido con benralizumab se traduce en un mejor control clínico del asma y, para la dosificación de 8 semanas, en una mejora de la calidad de vida.
Tabla I. CALIMA
Tabla II. SIROCCO
Bibliografía
- FitzGerald JM, Bleecker ER, Nair P, Korn S, Ohta K, Lommatzsch M, et al. Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet, 2016.
- Bleecker ER, FitzGerald JM, Chanez P, Papi A, Weinstein SF, Barker P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet, 2016.