Benralizumab versus Mepolizumab for Eosinophilic Granulomatosis with Polyangiitis
Opinión del Experto: Dra. Hemily Katerine Izaguirre Flores. Servicio de Neumología, Complejo Hospitalario Universitario de Canarias (CHUC).
Autores: Wechsler, Michael E; Nair Parameswaran; Terrier Benjamin; Walz Bastian; Bourdin Arnaud, et al.
Referencia: N Engl J Med 2024;390:911-921.doi: 10.1056/NEJMoa2311155
Palabras claves: granulomatosis eosinofílica con poliangeítis, mepolizumab, benralizumab.
Resumen:
La con poliangeítis (GEPA o EGPA) es un trastorno inflamatorio poco común caracterizado por asma, vasculitis necrotizante, granulomas extravasculares y eosinofilia sanguínea y tisular 1-3. En la actualidad, la primera y única terapia dirigida aprobada para el tratamiento de este raro trastorno, es el mepolizumab, un anticuerpo monoclonal que inhibe la interleucina 5 (IL5) implicada en la proliferación maduración y diferenciación del eosinófilo y que está presente en niveles elevados en los pacientes con GEPA4,5. El benralizumab, un anticuerpo monoclonal contra el receptor de interleucina 5α (IL5Rα) expresado en los eosinófilos, tiene la capacidad para deplecionar los eosinófilos en sangre y en tejido, lo que sugiere que pudiera ser una opción para tratar la GEPA6.
El ensayo MANDARA es un estudio de no inferioridad, multicéntrico, doble ciego, de 52 semanas, fase 3, aleatorizado y controlado con tratamiento activo para evaluar la eficacia y seguridad de benralizumab en comparación con mepolizumab en adultos con GEPA refractaria (definida por tener antecedentes de al menos una recaída confirmada de GEPA, es decir, que requiera un aumento en la dosis de corticoides orales iniciada por el investigador, inicio/aumento de la dosis de terapia inmunosupresora u hospitalización) en los últimos 2 años, que haya ocurrido ≥12 semanas antes de la selección (visita 1) mientras recibe una dosis de prednisolona (o equivalente) de ≥7,5 mg/día. Los adultos con GEPA recurrente o refractaria a pesar de tratamiento con corticoides orales (7,5 a 50 mg de prednisolona al día o equivalente, con una dosis estable ≥ 4 semanas) con o sin terapia inmunosupresora asociada, fueron aleatorizados en una proporción 1:1 para recibir benralizumab (30 mg en 1 inyección) o mepolizumab (300 mg en tres inyecciones de 100 mg cada una) administrado por vía subcutánea cada 4 semanas. Se incluyeron 140 pacientes (70 en cada grupo de tratamiento) y se excluyeron aquellos pacientes que habían tenido una GEPA grave con afectación de órganos vitales en los 3 meses previos a la primera visita.
 El objetivo principal fue la remisión de la enfermedad (definida como una BVAS de 0 y una dosis de corticoides orales ≤ 4 mg/día prednisolona) en las semanas 36 y 48 (margen de no inferioridad preespecificado, – 25 puntos porcentuales).
El objetivo principal fue la remisión de la enfermedad (definida como una BVAS de 0 y una dosis de corticoides orales ≤ 4 mg/día prednisolona) en las semanas 36 y 48 (margen de no inferioridad preespecificado, – 25 puntos porcentuales).
El porcentaje ajustado de pacientes con remisión en las semanas 36 y 48 fue de 59% en el grupo de benralizumab y del 56% en el grupo de mepolizumab (diferencia, 3 puntos porcentuales; 95% IC, -18 a 18; p=0,73 para superioridad), mostrando no inferioridad, pero no superioridad de benralizumab sobre mepolizumab,
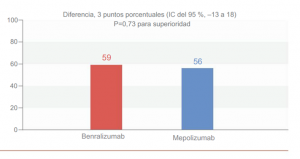
Gráfico 1. Remisión en las semanas 36 y 48.
En ambos grupos, el 30% de los pacientes tuvieron una recaída, la duración de remisión acumulada y el tiempo transcurrido hasta la primera recaída fueron similares. Durante las semanas 48 a 52, tanto en el grupo de benralizumab como en el de mepolizumab, el 70% de los pacientes recibieron ≤ 4 mg de corticoides orales (odds ratio 1,42;95% IC, 0,77 a 2.62), el 86% de los pacientes del grupo de benralizumab y el 74% del grupo de Mepolizumab alcanzaron al menos una reducción del 50% de la dosis de corticoides orales (diferencia, 12 puntos porcentuales;95% IC, -1 a 25) y la retirada completa de los corticoides orales se logró en el 41% de los pacientes con benralizumab y en el 26% de los pacientes del grupo de Mepolizumab (diferencia, 16 puntos porcentuales; 95% IC, 1 a 31).
Se informaron efectos adversos en el 90% de los pacientes que recibieron benralizumab y en el 96% de los que recibieron mepolizumab. Los efectos adversos notificados con mayor frecuencia fueron enfermedad por coronavirus (COVID19) en el 21% de los pacientes del grupo de benralizumab y en el 27% de los del grupo de mepolizumab, dolor de cabeza (17% y 16%) y artralgia (17% y 11%) respectivamente.
Comentario:
Este es el primer estudio “head to head” que compara la efectividad de un biológico frente a otro para el tratamiento de la GEPA refractaria, en el que se demuestra la no inferioridad, sin obtener superioridad, del benralizumab frente al mepolizumab en la remisión de la enfermedad en las semanas 36 y 48. En este estudio con ambos tratamientos, se logró un alto porcentaje de remisión de la enfermedad (>50%), reducción >50% de la dosis de corticoides orales (70%), alcanzando su retirada en una importante proporción de pacientes incluso superior a la observada en el estudio MIRRA7, lo que sugiere que la utilización tanto del mepolizumab como del benralizumab en el tratamiento de la GEPA puede ayudar a mejorar el control de la enfermedad evitando las recurrencias, reducir e incluso suspender con seguridad el uso de los corticoides orales y en consecuencia su temidos efectos secundarios.
En el campo de la GEPA es necesario seguir trabajando para comprender el papel de los fármacos antiIL5 y IL5Rα y su utilidad en la enfermedad no refractaria y en las formas más graves de la enfermedad y el reto futuro es posicionar correctamente estos fármacos frente a los inmunosupresores.
Referencias:
- Wechsler ME, Munitz A, Ackerman SJ, et al. Eosinophils in health and disease: a state-of-the-art review. Mayo Clin Proc 2021;96:2694-707.
- Furuta S, Iwamoto T, Nakajima H. Update on eosinophilic granulomatosis with polyangiitis. Allergol Int 2019;68: 430-6.
- Jennette JC, Falk RJ, Bacon PA, et al. 2012 revised International Chapel Hill Consensus Conference nomenclature of vasculitides. Arthritis Rheum 2013;65:1-11.
- Menzies-Gow A, Flood-Page P, Sehmi R, et al. Anti-IL-5 (mepolizumab) therapy induces bone marrow eosinophil maturational arrest and decreases eosinophil progenitors in the bronchial mucosa of atopic asthmatics. J Allergy Clin Immunol 2003;111:714-719.
- Food and Drug Administration. FDA approves first drug for eosinophilic granulomatosis with polyangiitis, a rare disease formerly known as the Churg-Strauss syndrome. Press release, December 12, 2017.
- Laviolette M, Gossage DL, Gauvreau G, et al. Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia. J Allergy Clin Immunol 2013;132(5):1086-1096.e5.
- Wechsler ME, Akuthota P, Jayne D, et al. Mepolizumab or placebo for eosinophilic granulomatosis with polyangiitis. N Eígl J Med 2017;376:1921-1932.







