Effectiveness of fevipiprant in reducing exacerbations in patients with severe asthma (LUSTER-1 and LUSTER-2): two phase 3 randomised controlled trials. The Lancet Respiratory Medicine
Autores
Brightling CE, Gaga M, Inoue H, Li J, Maspero J, Wenzel S, Maitra S, Lawrence D, Brockhaus F, Lehmann T, Brindicci C, Knorr B, Bleecker ER. Lancet Respir Med. 2021;9(1):43-56. doi: 10.1016/S2213-2600(20)30412-4
Epub 2020 Sep 24. PMID: 32979986.Enlace:https://pubmed.ncbi.nlm.nih.gov/32979986/
Revisor
Dr. Francisco Javier Callejas González
Servicio de Neumología. Complejo Hospitalario Universitario de Albacete (CHUA).
Palabras clave: asma grave, fevipiprant, vía oral, exacerbaciones
Resumen
En el asma, la expresión del receptor 2 de prostaglandina D2 (receptor DP2) aumenta en la submucosa bronquial y su ligando, la prostaglandina D2, se eleva en el lavado broncoalveolar y, además, aumenta más tras la exposición frente a alérgenos. La estimulación del receptor DP2 por parte de la prostaglandina D2 media la activación y migración de algunos de los tipos de células inflamatorias clave en el asma, incluidas las células T-helper-2 (Th2), las células linfoides innatas de tipo 2, los basófilos y los eosinófilos, y estimula la liberación de citocinas de tipo 2 de estas células, así como la migración de las células del músculo liso de las vías respiratorias. Por otro lado, se ha observado que la expresión de ARNm del receptor DP2 tanto en las células de lavado broncoalveolar como en las células CD4+ TH2 circulantes, aumenta con la gravedad del asma. Por tanto, en conjunto, estos hallazgos implican al eje de las prostaglandinas D2-DP2 en la patogenia del asma.
Hasta la fecha, se han desarrollado e investigado varios antagonistas del receptor DP2 de prostaglandina D2 (receptor DP2) en ensayos clínicos de asma, ninguno de los cuales habían completado ensayos de fase 3, ya sea por ausencia de eficacia o por un perfil de seguridad adverso.
El fevipiprant es un antagonista oral, no esteroide, altamente selectivo y reversible del receptor DP2 que mostró resultados prometedores en tres ensayos clínicos fase 2,2-5 pues mejoró la función pulmonar y la clínica según el cuestionario de control del asma y redujo significativamente los eosinófilos en esputo (de 3 a 5 veces más respecto al placebo), una magnitud de reducción similar a la observada con la terapia biológica dirigida a interleucina-5 (IL-%). Dado que la eosinofilia elevada en el esputo predice exacerbaciones y mal control en pacientes con asma, el objetivo de los autores del estudio fue investigar si el fevipiprant reduce las exacerbaciones del asma en pacientes con asma grave en dos ensayos clínicos de fase 3 (LUSTER-1 y LUSTER-2).
Respecto al método, ambos estudios de fase 3 (LUSTER-1 y LUSTER-2) fueron aleatorizados, doble ciego, controlados con placebo, de grupos paralelos, replicados a 52 semanas. El LUSTER-1 se llevó a cabo en 174 centros clínicos de 25 países, y el LUSTER 2, en 169 centros clínicos de 19 países. Se agregó fevipiprant o placebo a la terapia de los escalones de tratamiento 4 y 5 de la GINA en adolescentes (≥ 12 años) y adultos con asma grave, asignados aleatoriamente mediante el uso de tecnología de respuesta interactiva a uno de los tres grupos de tratamiento (fevipiprant 150 mg una vez al día, 450 mg de fevipiprant o placebo) en una proporción de 1:1:1 dentro de cada uno de los estratos de aleatorización: recuentos de eosinófilos en sangre periférica (< 250 células por μL o ≥ 250 células por μL), edad del paciente (< 18 años o ≥ 18 años) y uso o no de corticosteroides orales como parte de su tratamiento estándar para el asma. El criterio principal de valoración de la eficacia fue la tasa anualizada de exacerbaciones del asma de moderadas a graves con dosis de 150 mg o 450 mg de fevipiprant una vez al día en comparación con placebo durante 52 semanas, en pacientes con recuentos elevados de eosinófilos en sangre (≥ 250 células por μl) y en población de estudio.
En cuanto a los resultados de los estudios, entre el 11 de diciembre de 2015 y el 25 de octubre de 2018, 894 pacientes fueron asignados aleatoriamente a fevipiprant 150 mg (n = 301), fevipiprant 450 mg (n = 295) o placebo (n = 298) en el LUSTER-1; entre el 3 de diciembre de 2015 y el 10 de julio de 2018, 877 pacientes fueron asignados aleatoriamente a fevipiprant 150 mg (n = 296), fevipiprant 450 mg (n = 294) o placebo (n = 287) en el LUSTER-2. En la población con elevados recuentos de eosinófilos en sangre periférica (≥ 250 células por μL), en el LUSTER-1, la tasa anualizada de exacerbaciones de moderadas a graves en comparación con placebo fue de 1,04 (IC 95%, 0,77-1,41) para fevipiprant 150 mg y 0,83 (0,61-1,14) para fevipiprant 450 mg, y en el LUSTER-2 fue de 0,69 (0,50-0,96) para fevipiprant 150 mg y 0,72 (0,52-1,01) para fevipiprant 450 mg. En la población general, en el LUSTER-1 la tasa anualizada de exacerbaciones de moderadas a graves en comparación con placebo fue de 0,96 (IC 95%, 0,75-1,22) para fevipiprant 150 mg y 0,78 (0,61-1,01) para fevipiprant 450 mg, y en el LUSTER-2, de 0,82 (0,62-1,07) para fevipiprant 150 mg y 0,76 (0,58-1,00) para fevipiprant 450 mg. En la población global combinada de ambos estudios, se produjeron acontecimientos adversos graves en 53 pacientes (9%) en el grupo de fevipiprant 150 mg, 50 (9%) en el grupo de fevipiprant 450 mg, y 50 (9%) en el grupo de placebo. Los eventos adversos que llevaron a la muerte ocurrieron en dos pacientes (< 1%) en el grupo de fevipiprant 450 mg y tres (< 1%) en el grupo de placebo. La figura 1 muestra el diseño de los estudios LUSTER-1 y LUSTER-2; la figura 2, los diagramas de flujo de ambos estudios; la figura 3, la tasa anualizada de exacerbaciones de moderadas a graves versus placebo para ambos estudios; y la figura 4, los resultados agrupados de LUSTER-1 y LUSTER-2.
Figura 1. Diseño de estudio de LUSTER-1 y LUSTER-2
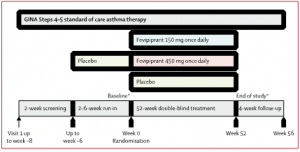
Los pacientes de 12 años o más con asma grave no controlada adecuadamente que recibían tratamiento estándar según los escalones de tratamiento 4 y 5 de GINA fueron asignados al azar (1:1:1) para recibir una vez al día fevipiprant 450 mg, fevipiprant 150 mg o placebo. El estudio incluyó un período previo de detección de 2 semanas, uno de preinclusión de 2 a 6 semanas para adaptarse a los pacientes con exacerbaciones del asma y recopilar datos de referencia para las variables de eficacia y medir el cumplimiento con un dispositivo electrónico de flujo máximo eDiary, uno de tratamiento de 52 semanas, y finalmente un período de seguimiento de 4 semanas tras la última dosis del fármaco del estudio.
Tras los resultados de estos dos estudios, los autores concluyen que, aunque ninguno de los ensayos mostró una reducción estadísticamente significativa en las exacerbaciones del asma después de ajustar por múltiples pruebas, se observaron reducciones constantes y modestas en las tasas de exacerbaciones en ambos estudios con la dosis de 450 mg de fevipiprant. La implicación de los hallazgos encontrados sugiere que, dado que la inhibición del receptor DP2 con fevipiprant se asocia con reducciones en las exacerbaciones del asma y mejoras en la función pulmonar, los antagonistas del receptor DP2 con una potencia más elevada o un tiempo de residencia sobre el receptor más largo que el fevipiprant pueden obtener una mayor eficacia clínica.
Figura 2. Diagramas de flujo de los estudios LUSTER-1 (A) y LUSTER-2 (B)
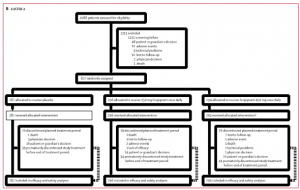
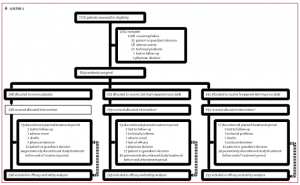
Figura 3. Tasa anualizada de exacerbaciones de moderadas a graves versus placebo para LUSTER-1 y LUSTER-2
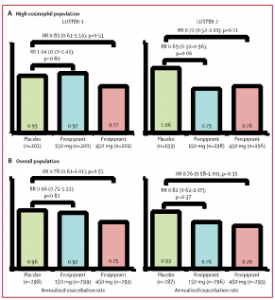
(A) Población con elevados recuentos de eosinófilos en sangre periférica. (B) Población general.
Los datos son IC del 95% y los valores de p están ajustados. RR = razón de tasas.
Figura 4. Resultados agrupados de los estudios LUSTER-1 y LUSTER-2
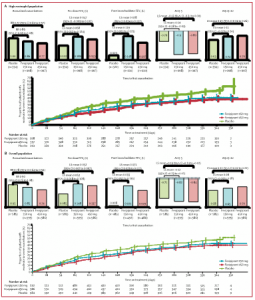
Tasas de exacerbación anualizadas y RR (IC del 95%) versus placebo y tiempo hasta la primera exacerbación, y cambio desde el inicio (medias LS) y la comparación del tratamiento (medias LS versus placebo; IC del 95%) en el FEV1 antes de la dosis, el FEV1 después del broncodilatador (criterio de valoración exploratorio), ACQ-5 y AQLQ + 12 en la población con alto contenido de eosinófilos (A) y la población general (B). RR = razón de tasas. LS = mínimos cuadrados. ACQ = cuestionario de control del asma. AQLQ = Cuestionario de calidad de vida para el asma.
Comentario
Aunque los hallazgos con fevipiprant en fase 2 eran muy halagüeños, los hallazgos realizados en fase 3 para confirmar la teoría de su efectividad sobre la reducción de las exacerbaciones no han sido los esperados, pero confirman la implicación del eje de las prostaglandinas D2-DP2 en la patogenia del asma. Por tanto, si posteriormente pudiesen confirmarse mejores resultados con fevipiprant o pudieran desarrollarse antagonistas del receptor DP2 con una potencia más elevada o un tiempo de residencia sobre el receptor más largo que el fevipiprant, el tratamiento con este tipo de terapia biológica podría obtener una mayor eficacia clínica, con el consiguiente mejor control del asma grave.
Bibliografía
- Brightling CE, Gaga M, Inoue H, Li J, Maspero J, Wenzel S, Maitra S, Lawrence D, Brockhaus F, Lehmann T, Brindicci C, Knorr B, Bleecker ER. Effectiveness of fevipiprant in reducing exacerbations in patients with severe asthma (LUSTER-1 and LUSTER-2): two phase 3 randomised controlled trials. Lancet Respir Med. 2021;9(1):43-56. doi: 10.1016/S2213-2600(20)30412-4. Epub 2020 Sep 24. PMID: 32979986. Enlace:https://pubmed.ncbi.nlm.nih.gov/32979986/.
- Erpenbeck VJ, Popov TA, Miller D, et al. The oral CRTh2 antagonist QAW039 (fevipiprant): a phase II study in uncontrolled allergic asthma. PulmPharmacolTher. 2016;39:54-63.
- Bateman ED, Guerreros AG, Brockhaus F, et al. Fevipiprant, an oral prostaglandin DP2 receptor (CRTh2) antagonist, in allergic asthma uncontrolled on low-dose inhaled corticosteroids. Eur Respir J. 2017;50:1-11.
- Gonem S, Berair R, Singapuri A, et al. Fevipiprant, a prostaglandin D2 receptor 2 antagonist, in patients with persistent eosinophilic asthma: a single-centre, randomised, double-blind, parallel-group, placebo-controlled trial. Lancet Respir Med. 2016;4:699-707.
- Saunders R, Kaul H, Berair R, et al. DP2 antagonism reduces airway smooth muscle mass in asthma by decreasing eosinophilia and myofibroblast recruitment. Sci Transl Med. 2019;11: eaao6451.