Astegolimab (anti-ST2) efficacy and safety in adults with severe asthma: A randomized clinical trial
Autores
Kelsen SG, Agache IO, Soong W, Israel E, Chupp GL, Cheung DS, Theess W, Yang X, Staton TL, Choy DF, Fong A, Dash A, Dolton M, Pappu R, Brightling CE. J Allergy ClinImmunol. 2021 DOI 10.1016/j.jaci.2021.03.044
Revisora
Elena Curto Sánchez
Unidad de Asma, Servicio de Neumología y Alergia. Hospital de la Santa Creu i Sant Pau (Barcelona)
Palabras clave: asma grave, anticuerpo monoclonal, tratamiento biológico, IL-33, astegolimab, estudio ZENYATTA
En el momento actual, los anticuerpos monoclonales disponibles para el asma grave no controlada están destinados únicamente a pacientes con inflamación T2. Hay algunas moléculas en fase de ensayo destinadas a los pacientes no T2, con diferentes dianas terapéuticas, como la IL-17 o la IL-33. La relación de la IL-33 con la susceptibilidad y la gravedad del asma se ha establecido a nivel biológico y genético. Se trata de una interleucina de la familia de la IL-1 que es liberada por el epitelio en respuesta a diferentes estímulos, como las infecciones víricas o la exposición a alérgenos. Tras la unión con su receptor, puede desencadenar respuestas de tipo Th1 o Th2 en función del microambiente inflamatorio produciendo liberación de TNFα, IFNγ, IL-5, IL-6, IL-9 e IL-13. El astegolimab es una IgG humana que bloquea el receptor de IL-33, llamado ST-2 (receptor 1 tipo IL-1), que está presente en células linfoides innatas (ILCs), mastocitos, linfocitos T, eosinófilos, células dendríticas, macrófagos y células endoteliales. Debido a la ubicuidad de este receptor, es posible que su bloqueo consiga beneficios en pacientes con asma grave no controlada independientemente de los niveles de eosinófilos.
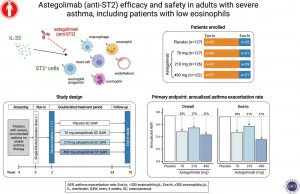
Esta publicación muestra los resultados del primer estudio de fase 2b del astegolimab, llamado estudio ZENYATTA. Es un estudio doble ciego, controlado con placebo, que incluyó tres ramas de tratamiento con dosis de 70, 210 o 490 mg de astegolimab subcutáneo cada 4 semanas. Los criterios de inclusión fueron: edad 18-75 años, asma grave en tratamiento con glucocorticoides inhalados (GCI) a dosis medias o altas y un segundo fármaco controlador, FEV1 entre 40 y 80% del valor de referencia, ACQ ≥ 1,5, al menos una exacerbación en el año previo, y uso de rescates con agonistas beta2 de acción rápida (SABA) al menos dos veces por semana o al menos un despertar nocturno semanal debido al asma. No se estableció ningún criterio analítico, pero el diseño de aleatorización garantizó la inclusión de 30 pacientes con alto nivel de eosinófilos (≥ 300 células/mL) y 95 pacientes con eosinófilos bajos (< 300 células/mL) por rama.
El objetivo principal fue la reducción de la tasa de exacerbaciones de asma en la semana 54 respecto a placebo. Las exacerbaciones se definieron como empeoramiento del asma que requiriera visitas a urgencias u hospitalización que resultara en la administración de glucocorticoides sistémicos (GCS) y/o tratamiento con GCS durante más de tres días (incluyendo presentaciones depot). Los objetivos secundarios fueron el tiempo hasta la primera exacerbación, el cambio en el FEV1 y el ACQ, el uso de rescates y los despertares nocturnos y los síntomas diarios medidos en un registro electrónico.
Fueron randomizados un total de 502 pacientes: 122 en la rama de 490 mg, 126 en la de 210 mg, 127 en la de 70 mg y 127 en la rama placebo. Los grupos estaban pareados por características clínicas; en general, hubo un predominio femenino, la edad media fue de 53 años y el IMC fue de 27,94.
La reducción relativa de exacerbaciones respecto a placebo fue de 43% (p = 0,0049), 21,9% (p = 0,1838) y 36,0% (0,0144) de mayor a menor dosis. En el grupo de < 300 eosinófilos, estas cifras fueron de 53,6% (p = 0,0016), 13,5% (p = 0,4843) y 34,9% (p = 0,0473), y en el grupo de > 300, 10,2% (p = 0,7718), 48,4% (p = 0,149) y 39,9% (p = 0,1891). En el grupo de < 150 eosinófilos/mm3, las reducciones observadas no alcanzaron la significación estadística en ninguna de las ramas.
Respecto a los objetivos secundarios, la dosis más elevada fue la que mostró mayor tiempo hasta la primera exacerbación. Ningún grupo mostró mejoría significativa a nivel de función pulmonar, aunque los mejores resultados se observaron en la rama de 490 mg y en pacientes con menos de 150 eosinófilos/mm3. La mayor mejoría en el ACQ fue en el grupo de 490 mg, pero no alcanzó la significación estadística y no se observaron diferencias en los síntomas registrados por los pacientes.
Los efectos adversos más frecuentes fueron síntomas de asma, nasofaringitis, cefalea y reacciones locales en el sitio de inyección (5% de incidencia en los grupos de tratamiento vs 0,8% en el grupo placebo). Se reportaron 37 efectos adversos graves, la mayoría agudizaciones de asma o neumonías. Se dio un caso de livedo reticulares en las 48 h posteriores a la segunda dosis de 70 mg y se decidió discontinuar la administración. Dos pacientes fallecieron durante el estudio, uno debido a una exacerbación de asma y otro por causa no aclarada (rama de 490 mg). Respecto a las reacciones de hipersensibilidad, hubo un caso moderado (490 mg) y una reacción de anafilaxia (placebo). En un 7,3% de los pacientes se detectaron anticuerpos antifármacos, que no parecieron afectar ni la seguridad ni la eficacia ni la farmacodinamia.
En este primer estudio de eficacia y seguridad del astegolimab, la dosis de 490 mg ha demostrado reducción de las exacerbaciones respecto a placebo en pacientes con > 50 eosinófilos/mm3 pero escaso impacto a nivel de función pulmonar o calidad de vida. El astegolimab ha mostrado ser un fármaco seguro. Se necesitan más estudios para comprobar la eficacia de las diferentes dosis propuestas y la población que obtendría mayores beneficios con su administración.







