Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial
Artículo seleccionado
Busse WW, Bleecker ER, FitzGerald JM, Ferguson GT, Barker P, Sproule S, Olsson RF, Martin UJ, Goldman M; BORA study investigators.
Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial.
LancetRespirMed. 2019 Jan;7(1):46-59. doi: 10.1016/S2213-2600(18)30406-5. Epub 2018 Nov 8.
Revisor
Dr. Francisco Javier Callejas González
Servicio de Neumología. Complejo Hospitalario Universitario de Albacete (CHUA).
Tema: Seguridad y eficacia a largo plazo del benralizumab en pacientes con asma grave no controlada: resultados a 1 año de la extensión del ensayo clínico BORA en fase 3.
Palabras clave: Benralizumab, asma eosinofílica, BORA.
Resumen
Existen pacientes que, a pesar de los tratamientos clásicos, presentan un control y una evolución deficientes de su asma. Por ello, un enfoque es apuntar a la eosinofilia como posible diana para el tratamiento, puesto que está presente en aproximadamente el 50% de los pacientes con asma y se asocia con la gravedad del mismo (mayor frecuencia de exacerbaciones y disminución de la función pulmonar).
El benralizumab es un anticuerpo monoclonal frente al receptor de interleucina-5 (IL-5) que induce el agotamiento directo, rápido y casi completo de los eosinófilos al mejorar la citotoxicidad mediada por células dependientes de anticuerpos. En Europa, está indicado para añadirlo en el tratamiento de mantenimiento de pacientes adultos con asma eosinofílica grave que no se controlan adecuadamente a pesar del tratamiento con corticosteroides inhalados en dosis altas y agonistas β2 de acción prolongada.
Actualmente existen tres ensayos de fase 3 que han estudiado la eficacia de este fármaco:
- Ensayo SIROCCO de 48 semanas y ensayo CALIMA de 56 semanas, que investigaron el efecto del benralizumab en dosis de 30 mg cada 4 semanas (Q4W) o cada 8 (Q8W) comparado con un placebo, estudiando la tasa anual de exacerbaciones en pacientes de edades comprendidas entre 12 y 75 años con asma grave e incontrolada.
Los estudios demostraron que el benralizumab combinado con dosis altas de corticosteroides inhalados y agonistas β2 de acción prolongada redujo significativamente las exacerbaciones del asma y mejoró la función pulmonar y el control de la enfermedad en pacientes con un recuento de eosinófilos de 300 células por μL o más al inicio del estudio. En los pacientes que recibieron 30 mg de benralizumab 8 semanas, la tasa de exacerbación anual se redujo en un 51% (ensayo SIROCCO) o en un 28% (ensayo CALIMA) en comparación con placebo.
- Ensayo ZONDA: Ensayo de fase 3 de 30 mg de benralizumab (Q4W o Q8W) versus placebo que incluyó a pacientes adultos con asma grave no controlada con un contaje de eosinófilos en sangre de ≥ 150 células por μL. El objetivo primario del estudio era reducir las dosis del tratamiento esteroideo oral, con una reducción de las dosis de los mismos en la semana 28 del 75% para benralizumab frente a un 25% con placebo (p < 0,001 para la diferencia entre los grupos).
El objetivo del estudio presentado (ensayo BORA) fue la evaluación de la seguridad y la eficacia a largo plazo (2 años) de este fármaco en pacientes con asma grave eosinofílica no controlada.
Todos los pacientes que participaron anteriormente y completaron los ensayos SIROCCO, CALIMA o ZONDA fueron incluidos en el ensayo BORA, y estos pacientes fueron tratados en BORA durante 56 semanas (adultos) o 108 semanas (adolescentes) con 30 mg de benralizumab, ya sea Q4W o Q8W.
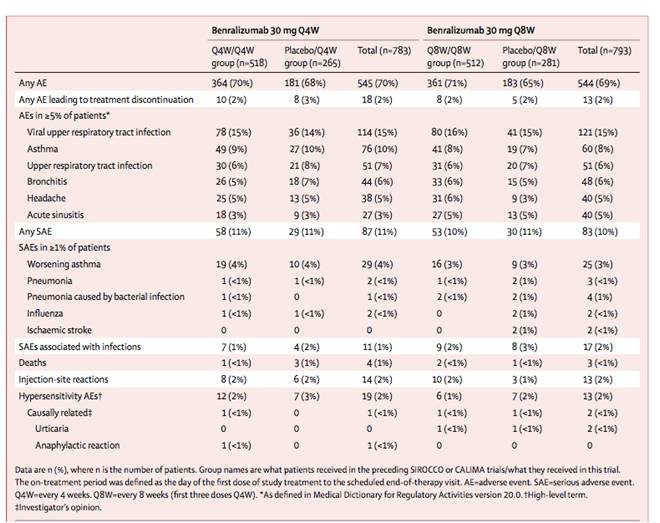
Comparando los estudios descritos hasta la fecha, los eventos adversos más comunes en BORA también fueron los eventos más comunes en SIROCCO y CALIMA, excepto por la nasofaringitis (en el 1% de los pacientes en BORA y entre el 12 y el 21% de los pacientes en SIROCCO o CALIMA) y la infección viral del tracto respiratorio superior (en el 15-16% de los pacientes en BORA y en ningún caso en SIROCCO o CALIMA) (Tabla I). En BORA, los porcentajes de pacientes que tuvieron algún efecto adverso durante el tratamiento fueron similares entre los distintos grupos, al igual que al compararlo con los resultados de los otros ensayos realizados hasta la fecha (SIROCCO o CALIMA). En SIROCCO o CALIMA, el porcentaje de efectos secundarios osciló entre un 71 y un 75%, mientras que en BORA fue entre un 65 y un 71%. Al igual que el porcentaje de pacientes que tuvieron un evento adverso que llevó a la interrupción del tratamiento, esto es, 2% en SIROCCO y CALIMA vs 2-3% en BORA. El mayor número de efectos adversos graves se observó en este ensayo (BORA, 9 pacientes, frente a 6 en SIROCCO y CALIMA), pero es posible que se trate de un sesgo, puesto que en BORA los investigadores sabían que sus pacientes estaban recibiendo benralizumab, mientras que, en los estudios primarios anteriores, los pacientes podrían haber estado recibiendo benralizumab o placebo.
La eosinofilia periférica se recuperó después de la interrupción del tratamiento con benralizumab, lo que indica que los efectos en la reducción de los eosinófilos no se asocian con la supresión a largo plazo de la médula ósea tras la retirada de la medicación. Este estudio también indica que el benralizumab beneficia a pacientes con un amplio rango de niveles basales de eosinófilos en la sangre, aunque aquellos pacientes con recuentos más elevados de eosinófilos podrían obtener mayores beneficios del tratamiento, en consonancia con los hallazgos anteriores utilizando los resultados combinados de SIROCCO y CALIMA.
Además, los resultados favorables de eficacia (tasa de exacerbación, función pulmonar y síntomas de asma) con benralizumab observados en SIROCCO y CALIMA se mantuvieron en el año adicional de tratamiento en BORA.
Finalmente, de forma conceptual, se piensa que un tratamiento más prolongado con benralizumab podría afectar a mecanismos fisiopatológicos, como la formación de tapones mucosos eosinofílicos, cambios inflamatorios y disminución de la tasa de mejora de la función pulmonar asociada con las exacerbaciones, pero estos efectos deberán investigarse en el futuro.
Tabla I. Efectos adversos, reacciones en el lugar de la inyección e hipersensibilidad durante el período de tratamiento.
Comentario
Los resultados de este estudio (BORA) apoyan el uso del benralizumab para el tratamiento de mantenimiento de pacientes con asma grave no controlada con un fenotipo eosinofílico. Se trata de un anticuerpo monoclonal antieosinófilo que puede utilizarse de una manera segura y eficaz, pues presenta un perfil de seguridad y tolerabilidad a los dos años similar al observado durante 1 año en SIROCCO y CALIMA y, además, mantiene las mejoras en las medidas de eficacia tales como la tasa de exacerbación, la función pulmonar o los síntomas de asma, demostradas en los ensayos controlados aleatorios primarios anteriores. Además, se mantiene estable la reducción de los eosinófilos a largo plazo (que se recuperan posteriormente tras la suspensión del fármaco), y la incidencia de otros eventos adversos, incluidas las infecciones oportunistas.
Bibliografía
- Bleecker ER, FitzGerald JM, Chanez P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. 2016;388:2115-27.
- FitzGerald JM, Bleecker ER, Nair P, et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. 2016;388:2128-41.
- Busse WW, Bleecker ER, FitzGerald JM, Ferguson GT, Barker P, Sproule S, Olsson RF, Martin UJ, Goldman M; BORA study investigators. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. 2019 Jan;7(1):46-59. doi: 10.1016/S2213-2600(18)30406-5. Epub 2018 Nov 8.