Evaluation of the oral corticosteroid-sparing effect of tezepelumab in adults with oral corticosteroid-dependent asthma (SOURCE): a randomised, placebo-controlled, phase 3 study
Autores: Wechsler ME, Menzies-Gow A, Brightling CE, Kuna P, Korn S, Welte T, Griffiths JM, Sałapa K, Hellqvist A, Almqvist G, Lal H, Kaur P, Skärby T, Colice G, on behalf of the SOURCE study group.
Referencia: Lancet Respir Med. 2022;10:650–60. https://doi.org/10.1016/S2213-2600(21)00537-3
Revisor: Francisco Javier Callejas González. Servicio de Neumología. Complejo Hospitalario Universitario de Albacete (CHUA).
Palabras clave: tezepelumab, asma grave, asma corticodependiente, ahorro de corticosteroides
Resumen
Los pacientes con asma grave pueden requerir un tratamiento de mantenimiento diario a largo plazo con corticosteroides orales.1 Sin embargo, los pacientes que reciben tratamiento a largo plazo con corticosteroides orales tienen un mayor riesgo de mortalidad2 y efectos secundarios agudos y crónicos, incluidos trastornos metabólicos, osteoporosis,3,4 insuficiencia suprarrenal,4 neumonía,5 eventos adversos cardiovasculares, cataratas4,6 y aumento de peso.6 Además, la exposición crónica a los corticosteroides orales en pacientes con asma grave también se asocia con un aumento de los costes directos de atención médica y del uso de recursos.7 Los ensayos controlados aleatorizados de anticuerpos monoclonales dirigidos a las citoquinas tipo 2 (T2) (específicamente IL-4, IL-13 e IL-5) o sus respectivos receptores han demostrado que estos tratamientos pueden permitir la reducción gradual y la interrupción de la terapia con corticosteroides orales de mantenimiento en pacientes con asma grave dependiente de corticosteroides orales, particularmente en aquellos con asma eosinofílica.8-10
La linfopoyetina estromal tímica (TSLP) es una citoquina derivada de células epiteliales implicada en múltiples procesos implicados en la fisiopatología del asma.11-13 En los pacientes asmáticos, los niveles de TSLP se correlacionan con la obstrucción de las vías respiratorias, la gravedad de la enfermedad y la resistencia a los glucocorticoides, puesto que se ha demostrado que esta citoquina está implicada en el inicio y la persistencia de la inflamación de las vías respiratorias.14
El tezepelumab es un anticuerpo monoclonal humano (IgG2λ) que se une específicamente a la TSLP evitando que interactúe con su receptor heterodimérico.15 En los estudios de fase 3 NAVIGATOR y fase 2b PATHWAY, el tezepelumab redujo la tasa anualizada de exacerbaciones del asma (AAER) en comparación con el placebo en pacientes con asma grave no controlada y concentraciones basales altas o bajas de biomarcadores inflamatorios T2 (recuento de eosinófilos en sangre, recuento fraccional de óxido de nitrógeno exhalado [FeNO] e IgE total en suero), independientemente del estado alérgico, además de mejorar también la función pulmonar, el control del asma y la calidad de vida relacionada con la salud de los pacientes en la población general.15-16
Este trabajo, el estudio de fase 3 SOURCE, investiga la eficacia y la seguridad del tezepelumab para reducir la dosis de mantenimiento de corticosteroides orales en pacientes con asma dependiente de corticosteroides orales, además de evaluar su eficacia para reducir las exacerbaciones del asma y mejorar la función pulmonar, así como el control de la sintomatología del asma.17
El SOURCE fue un estudio de fase 3, multicéntrico, aleatorizado, doble ciego, controlado con placebo y de grupos paralelos realizado en 60 centros de siete países (Argentina, Alemania, Polonia, Corea del Sur, Turquía, Ucrania y Estados Unidos).
Los participantes tenían entre 18 y 80 años y asma diagnosticada por un médico y habían estado recibiendo corticosteroides inhalados en dosis media (dosis diaria de 250 a 500 μg de propionato de fluticasona o equivalente) o corticosteroides inhalados en dosis alta (dosis diaria de > 500 μg de propionato de fluticasona) o equivalente) durante al menos 12 meses antes de la selección, además de tratamiento con un agonista β2 de acción prolongada con o sin medicamentos de control adicionales durante al menos 3 meses antes de la selección y corticosteroides orales para el tratamiento del asma durante al menos 6 meses antes de la selección, en una dosis estable de prednisona o prednisolona de 7,5 a 30 mg diarios o su equivalente diario durante al menos 1 mes antes de la selección. Respecto a los pacientes que recibían corticosteroides inhalados en dosis medias, estos debían haber aumentado su dosis a una dosis alta durante al menos 3 meses antes de la selección. Además, los participantes también debían haber presentado al menos una exacerbación del asma, definida como un empeoramiento de los síntomas del asma que condujo a la hospitalización, a una visita a urgencias que resultó en el uso de corticosteroides sistémicos durante ≥3 días consecutivos o a la necesidad de corticosteroides sistémicos durante ≥3 días consecutivos en los 12 meses anteriores a la selección. Asimismo, debían tener un FEV1 matutino previo al broncodilatador inferior al 80% del valor normal previsto en la visita 1 (semana –10) o en la visita 2 (semana –8), habiéndose documentado una reversibilidad del FEV1 postbroncodilatador de, al menos, el 12 % y 200 ml durante los 12 meses anteriores a la selección, la visita 1 o la visita 2.
Respecto a la aleatorización y al enmascaramiento, los pacientes elegibles fueron asignados al azar de forma secuencial en una proporción de 1:1 para recibir tezepelumab o placebo de acuerdo con una secuencia de asignación al azar de bloques fijos generada por computadora. Dicha asignación al azar se estratificó por región y la población del estudio fue monitorizada para asegurar que aproximadamente el 35% de los participantes tuvieran recuentos de eosinófilos en sangre de, al menos, 300 células por μL en el momento de la inscripción.
En cuanto al procedimiento, tras un período de selección y preparación de 2 semanas, seguido de una fase de optimización de corticosteroides orales de hasta 8 semanas para confirmar la elegibilidad del paciente, los participantes fueron asignados aleatoriamente para recibir tezepelumab 210 mg (administrados con un vial y una jeringa de un solo uso) o placebo por vía subcutánea cada 4 semanas durante un período de tratamiento de 48 semanas (Figura 1). El período de tratamiento consistió en una fase de inducción de 4 semanas, durante la cual la dosis optimizada de corticosteroides orales se mantuvo estable, seguida de una fase de reducción de la dosis de 36 semanas y una fase de mantenimiento de 8 semanas, durante la cual no se permitieron más reducciones en la dosis de corticosteroides orales.
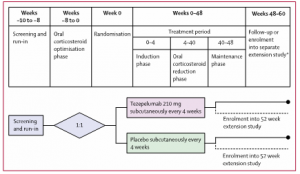
Figura 1. Diseño del estudio17
*Los participantes que se inscribieron en un estudio de extensión a largo plazo el mismo día de la visita de finalización del tratamiento en SOURCE no asistieron a las visitas de seguimiento en las semanas 54 y 60.
El criterio principal de valoración fue la reducción porcentual categorizada desde el inicio en la dosis diaria de corticosteroides orales en la semana 48 sin perder el control del asma. Las categorías se definieron como: (1) 90–100% de reducción; (2) reducción del 75% a menos del 90%; (3) reducción del 50% a menos del 75%; (4) 0 a menos del 50% de reducción; y (5) ningún cambio o aumento.
El objetivo secundario fue la valoración de la tasa anualizada de exacerbaciones del asma (AAER) a las 48 semanas. También se valoraron variables secundarias relacionadas con el uso de corticosteroides orales, que incluyeron la proporción de participantes en la semana 48 con una reducción del 100% desde el inicio en la dosis diaria de corticosteroides orales, una dosis diaria de 5 mg o menos o como mínimo una reducción del 50% de la dosis diaria desde el inicio, así como otros criterios de valoración secundarios, tales como el tiempo transcurrido hasta la primera exacerbación, la tasa de exacerbaciones asociadas con una visita al servicio de urgencias u hospitalización, síntomas clínicos y calidad de vida, según la medición de diversos cuestionarios, y el puntaje total y mediciones de biomarcadores inflamatorios (recuento de eosinófilos en sangre, FeNO y concentración sérica de IgE total). Por último, también se evaluaron la seguridad y la tolerancia del tezepelumab mediante el control de eventos adversos, eventos adversos graves, signos vitales, valores analíticos de sangre y orina y electrocardiogramas digitales.
Para ello, entre el 5 de marzo de 2018 y el 27 de septiembre de 2019 se inscribieron en el estudio 243 pacientes. De 150 participantes asignados al azar, 74 fueron asignados a tezepelumab 210 mg y 76 a placebo (Figura 2). De estos participantes, 68 (92%) asignados a tezepelumab y 73 (96 %) asignados a placebo completaron el estudio.
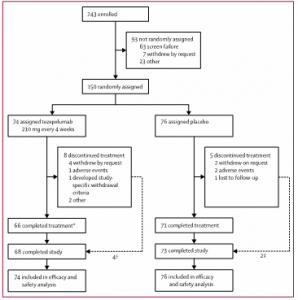
Figura 2. Perfil del estudio
*Dos participantes completaron el tratamiento pero se retiraron del estudio. †Cuatro participantes interrumpieron el tratamiento pero completaron las evaluaciones del estudio. ‡Dos participantes interrumpieron el tratamiento pero completaron las evaluaciones del estudio.
Las probabilidades acumuladas de lograr una categoría de mayor reducción porcentual en una dosis de corticosteroides orales para el mantenimiento diario en la semana 48 fueron similares con tezepelumab o placebo en la población general (odds ratio [OR] 1,28 [IC 95% 0,9-2,35], p=0,43), es decir, no se cumplió el objetivo principal, pero cuando se estratificó a los pacientes según el recuento de eosinófilos, las probabilidades acumuladas fueron mayores con tezepelumab que con placebo en participantes con recuentos de eosinófilos en sangre al inicio de, al menos, 150 células por μL (2,58 [1,16–5,75]), pero no en participantes con recuentos por debajo de 150 células por μL (0·40 [0·14–1·13]) (Tabla I).
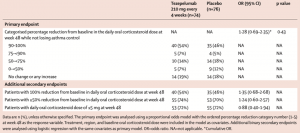
Tabla I. Resumen de criterios de valoración primarios y secundarios relacionados con la dosis diaria de corticosteroides orales.
En lo que respecta a la tasa anualizada de reducción de exacerbaciones, el grupo de tezepelumab tuvo una AAER de 1,38 (IC del 95 %: 0,98-1,95) a las 48 semanas en comparación con 2,00 (1,46-2,74) en el grupo de placebo. El cociente de tasas (RR) fue de 0,69 (IC del 95 %, 0,44-1,09), lo que corresponde a una reducción del 31%. En los participantes agrupados por el recuento inicial de eosinófilos en sangre, el RR fue de 0,43 (0,24-0,76) en aquellos con un recuento de eosinófilos en sangre de, al menos, 150 células por μL y 0,29 (0,14-0,63 ) en aquellos con un recuento de, al menos, 300 células por μL (que corresponde a una reducción del 57 % y el 71 %, respectivamente), y fue de 1,35 (0,64-2,87) en los participantes con recuentos por debajo de 150 células por μL. De los participantes que completaron el período de tratamiento planificado, la proporción de participantes que no tuvieron exacerbaciones durante el período de tratamiento planificado en el grupo de tezepelumab fue mayor (35 [47%] de 74) que la del grupo de placebo (26 [34%] de 76).
En relación a los cambios en la función pulmonar, en la semana 48 el cambio medio desde el inicio en el FEV1 prebroncodilatador fue de 0,21 l en el grupo de tezepelumab y de -0,04 l en el grupo de placebo (diferencia media de 0,26 l [IC del 95%: 0,13-0,39]). Las mejoras en el FEV1 se registraron ya en la semana 4 en el grupo de tezepelumab (el primer punto de tiempo de medición posterior al inicio fue durante la fase de inducción, en la que la dosis diaria de corticosteroides orales se mantuvo estable) y se mantuvieron durante todo el período de tratamiento, a pesar de reducciones en la dosis diaria de corticosteroides orales de mantenimiento (Figura 3).
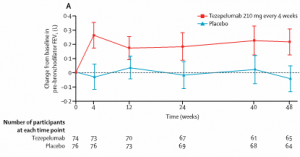
Figura 3. Cambio desde el inicio hasta la semana 48 en FEV1 prebroncodilatador.
Por último, en cuanto a la seguridad y la tolerancia, el tezepelumab fue bien tolerado y no se identificaron problemas de seguridad. En 53 (72%) de los 74 participantes asignados a tezepelumab y en 65 (86%) de los 76 participantes asignados a placebo se informó un evento adverso, que fue grave en 12 (16%) participantes en el grupo de tezepelumab y en 16 (21%) participantes en el grupo de placebo.
Los autores muestran que, aunque la investigación no cumplió con el objetivo principal de valoración de una reducción porcentual categorizada en la dosis diaria final de corticosteroides orales en la semana 48 con tezepelumab versus placebo, las probabilidades de lograr una categoría de mayor reducción porcentual en la dosis diaria de corticosteroides orales de mantenimiento en la semana 48 fueron mayores (aunque no significativamente) en el grupo de tezepelumab que en el grupo de placebo en pacientes con un recuento de eosinófilos en sangre basal de, al menos, 150 células por μL, además de observar reducciones numéricas en las exacerbaciones, mejoras clínicamente significativas en la función pulmonar y mejoras en el control del asma y la calidad de vida relacionada con la salud en el grupo de tezepelumab, al igual que en la reducción en el recuento de eosinófilos en sangre, FeNO y la concentración de IgE sérica total, con una buena tolerancia y perfil de seguridad.
Por ello, concluyen que, aunque no se observó una mejora estadísticamente significativa en la reducción de la dosis de corticosteroides orales en comparación con el placebo con el tratamiento con tezepelumab en la población general, sí hubo mejora en los participantes con recuentos basales de eosinófilos en sangre de al menos 150 células por μL, además del resto de parámetros estudiados, lo que indica que el tezepelumab tiene el potencial de ser beneficioso para los pacientes con asma grave corticodependiente.
Comentario
Los resultados de este estudio en fase 3 confirman alguno de los hallazgos ya comprobados en los estudios previos de fase 2, aunque todavía se necesitan más estudios para poder individualizar y focalizar el espectro de pacientes con asma grave en que el tezepelumab puede ser más beneficioso.
Bibliografía
- Global Initiative for Asthma. Global strategy for asthma management and prevention 2020 guidelines.
https://ginasthma.org/wp-content/uploads/2020/06/GINA-2020-report_20_06_04-1-wms.pdf (Jul 1, 2022).
- Lee H, Ryu J, Nam E, et al. Increased mortality in patients with corticosteroid-dependent asthma: a nationwide population-based study. Eur Respir J. 2019; 54: 1900804.
- Daugherty J, Lin X, Baxter R, Suruki R, Bradford E. The impact of long-term systemic glucocorticoid use in severe asthma: a UK retrospective cohort analysis. J Asthma. 2018;55:651-658.
- Sweeney J, Patterson CC, Menzies-Gow A, et al. Comorbidity in severe asthma requiring systemic corticosteroid therapy: cross-sectional data from the Optimum Patient Care Research Database and the British Thoracic Difficult Asthma Registry. Thorax. 2016;71:339-346.
- Price DB, Trudo F, Voorham J, et al. Adverse outcomes frominitiation of systemic corticosteroids for asthma: long-term observational study. J Asthma Allergy. 2018;11:193-204.
- Manson SC, Brown RE, Cerulli A, Vidaurre CF. The cumulative burden of oral corticosteroid side effects and the economic implications of steroid use. Respir Med. 2009;103:975-994.
- Bleecker ER, Menzies-Gow AN, Price DB, et al. Systematic literature review of systemic corticosteroid use for asthma management. Am J Respir Crit Care Med. 2020;201:276-293.
- Bel EH, Wenzel SE, Thompson PJ, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014; 371:1189-1197.
- Nair P, Wenzel S, Rabe KF, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N Engl J Med. 2017;376:2448-2458.
- Rabe KF, Nair P, Brusselle G, et al. Efficacy and safety of dupilumab in glucocorticoid-dependent severe asthma. N Engl J Med. 2018;378:2475-2485.
- Soumelis V, Reche PA, Kanzler H, et al. Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP. Nat Immunol. 2002;3:673-680.
- Ziegler SF, Roan F, Bell BD, Stoklasek TA, Kitajima M, Han H. The biology of thymic stromal lymphopoietin (TSLP). Adv Pharmacol. 2013;66:129-155.
- Chen ZG, Zhang TT, Li HT, et al. Neutralization of TSLP inhibits airway remodeling in a murine model of allergic asthma induced by chronic exposure to house dust mite. PLoS One. 2013;8:e51268.
- Gauvreau GM, Sehmi R, Ambrose CS, Griffiths JM. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert OpinTher Targets. 2020;24:777-792.
- Corren J, Parnes JR, Wang L, et al. Tezepelumab in adults with uncontrolled asthma. N Engl J Med. 2017;377:936-946.
- Menzies-Gow A, Corren J, Bourdin A, et al. Tezepelumab in adults and adolescents with severe, uncontrolled asthma. N Engl J Med. 2021;384:1800-1809.
- Wechsler ME, Colice G, Griffiths JM, et al. SOURCE: a phase 3, multicentre, randomized, double-blind, placebo-controlled, parallel group trial to evaluate the efficacy and safety of tezepelumab in reducing oral corticosteroid use in adults with oral corticosteroid dependent asthma. Respir Res. 2020;21:264.







