Derivation of a prototype asthma attack risk scale centred on blood eosinophils and exhaled nitric oxide.
Autores
Couillard S, Laugerud A, Jabeen M, Ramakrishnan S, Melhorn J, Hinks T, Pavord I.
Referencia
Thorax. 2021; 0:1-4 DOI 10.1136/thoraxjnl-2021-217325.
Revisor
Francisco Javier Callejas González
Servicio de Neumología. Complejo Hospitalario Universitario de Albacete (Albacete)
Palabras clave: FeNO, eosinofilia periférica, biomarcador pronóstico, exacerbaciones, asma.
Resumen
Inicialmente, el óxido nítrico (NO) fue valorado como una molécula contaminante ambiental. Sin embargo, en la actualidad ha pasado a ser un gas de considerable importancia biológica, con relevantes características como marcador inflamatorio. En la vía aérea, está sintetizado por la isoforma inducible de la enzima NO sintetasa, presente en diversos tipos celulares que participan en el proceso inflamatorio e inducida por diferentes citoquinas proinflamatorias y por productos bacterianos.
El FeNO se considera un biomarcador de gran relevancia en la enfermedad respiratoria, puesto que se ha demostrado que, al tratarse de un indicador importante de la inflamación de tipo 2 subyacente de las vías respiratorias, está elevado en los pacientes con asma.1-2 Durante mucho tiempo, ha sido infrautilizado, en parte debido a la falta de datos en lo que al pronóstico se refiere. Sin embargo, la guía de la American Thoracic Society (ATS) de 2011 reveló importantes avances sobre el uso del FeNO en la práctica clínica. Dicha guía recomendó la evaluación de FeNO como parte del diagnóstico inicial y el seguimiento de la inflamación de las vías respiratorias y remarcó su uso como indicador de respuesta al tratamiento con corticosteroides inhalados (ICS).3 De hecho, hoy en día es posible medir la cantidad de NO presente en el aire exhalado proveniente de la vía aérea y del alveolo pulmonar o fracción exhalada de óxido nítrico (FeNO) de manera no invasiva, económica y sencilla en las evaluaciones clínicas de rutina.4
Desde la publicación de la guía de la ATS en 2011, existe cada vez más evidencia de que en pacientes con asma moderada o grave los niveles de FeNO están elevados (≥25 ppb). Esta herramienta es de gran utilidad para identificar y guiar el tratamiento de los pacientes que probablemente responderán al tratamiento con ICS;3,5-6 además, puede predecir el riesgo de futuras exacerbaciones del asma.5 Como es conocido, uno de los principales objetivos del tratamiento actual del asma es reducir el riesgo de exacerbaciones. El problema es que el control de dichas exacerbaciones es complejo por diversos motivos. Por un lado, no se ha definido hasta qué punto el riesgo asociado con las características clínicas es independiente del fenotipo inflamatorio, y por otro, en lo que respecta a los factores de riesgo y desencadenantes de las exacerbaciones, no todos ellos se han identificado y algunos son difíciles de modificar.4
Además, como también se ha demostrado, las concentraciones de eosinófilos en sangre también predicen un mayor riesgo de asma. Sin embargo, a pesar de que tanto los niveles de FeNO como la eosinofilia se asocian con la inflamación de tipo 2, las vías de citosinas de ambos son diferentes, pero superpuestas. Todo ello pone de manifiesto que la eosinofilia y el FeNO han de considerarse indicadores de aspectos distintos de la inflamación y, por tanto, es planteable que ofrezcan una información independiente, en lo que al pronóstico se refiere.7-8
Actualmente se están llevando a cabo distintos ensayos clínicos sobre la gravedad del asma que evalúan la relación independiente entre eosinófilos en sangre, FeNO y el riesgo de exacerbaciones.4
A pesar de todas las evidencias recopiladas hasta la fecha, todavía no se ha establecido la importancia de un FeNO basal elevado como indicador de pronóstico del riesgo futuro de exacerbaciones graves en pacientes ya tratados con ICS ni la medida en que el FeNO proporciona información de pronóstico adicional cuando se combina con otros indicadores pronóstico.
Se realizó un análisis post-hoc del estudio de fase 3 Liberty Asthma QUEST para evaluar el valor pronóstico de los niveles de FeNO iniciales, teniendo en cuenta y en combinación con las posibles diferencias en el recuento basal de eosinófilos en sangre y otras características clínicas, para futuras exacerbaciones graves del asma en pacientes con asma no controlada, de moderada a grave, que recibieron tratamiento farmacológico no biológico, según las directrices de la Global Initiative for Asthma (GINA) de 2015.9 Se trataba de un estudio doble ciego de 52 semanas de duración en el que se incluyó a 620 pacientes con asma de moderada a grave que fueron asignados aleatoriamente a tratamiento y a placebo. Los pacientes incluidos presentaban asma no controlada con glucocorticoides inhalados con una o más exacerbaciones en el año previo, con unos valores de FEV1 que oscilaban del 40 al 80% y una reversibilidad del 12% o más y 200 ml, un ACQ-5 de 1,5 o más y niveles de FeNO, eosinófilos en sangre periférica e IgE total, sin un requisito mínimo basal.
La tasa anual de exacerbaciones graves se evaluó mediante los niveles de FeNO inicial (<25 ppb; ≥25 a <50 ppb; ≥50 ppb; modelo binomial negativo) y clasificados de forma cruzada por eosinófilos en sangre basales (<150 células por μL, ≥150 a <300 células por μL, ≥300 células por μL) y exacerbaciones previas (una, dos o más), todas ajustadas por ACQ-5 basal y FEV1 postbroncodilatador, entre otras características clínicas.
Los resultados revelaron que los pacientes con niveles más elevados de FeNO presentaban de forma significativa (p=0,0097) mayor número de exacerbaciones (1,54 veces mayor), tanto al comparar los pacientes con los niveles más elevados (FeNO basal ≥50 ppb; n=144) con los de menores niveles (<25 ppb; n=291) como al comparar a pacientes con niveles intermedios de FeNO (FeNO basal de 25 a <50 ppb, n=185, que tuvieron una tasa de exacerbaciones 1,33 veces mayor con respecto a los de FeNO de menos de 25 ppb (p=0,0572). Además, estos resultados fueron independientes de otras características clínicas, incluidas la historia de tabaquismo, el número de exacerbaciones graves un año antes del estudio, el tiempo transcurrido desde la última exacerbación de asma, la edad de inicio de la enfermedad, así como las evaluaciones de referencia para el FEV1, la puntuación del ACQ-5 postbroncodilatador, el recuento de eosinófilos en sangre y las concentraciones de IgE total en suero, lo que indica que el FeNO tiene valor pronóstico independiente de estas medidas.
Además, al comparar a los pacientes con menor FeNO, menor recuento de eosinófilos en sangre y menor número de exacerbaciones (FeNO basal de ≥25 ppb o más, recuento de eosinófilos en sangre de ≥150 células por μL, más de dos exacerbaciones previas (n=157)), tuvieron una tasa de exacerbaciones 3,62 veces mayor que los pacientes con FeNO de menos de 25 ppb, un recuento de eosinófilos en sangre de menos de 150 células por μL y una exacerbación (p=0,0011). Estos hallazgos, junto con la evidencia constante de que el FeNO y el recuento de eosinófilos en sangre se asocian con una buena respuesta a los corticosteroides y a las terapias biológicas frente a la respuesta inflamatoria T2,7,10-11 sugieren que la evaluación de los niveles de FeNO podría ser clínicamente muy útil para evaluar el riesgo futuro de exacerbaciones graves y también de la probable respuesta al tratamiento.
Este estudio, en consonancia con otros realizados,5,12 mantiene que el FeNO es un factor de riesgo para el uso crónico de corticosteroides incluso cuando se analiza independientemente de los biomarcadores de tipo 2, como el recuento de eosinófilos, lo que explica que son biomarcadores con vías de citosinas diferentes, aunque superpuestas. En apoyo de esta hipótesis, el estudio DREAM mostró que el recuento de eosinófilos en sangre disminuyó en respuesta al tratamiento con mepolizumab, mientras que los niveles de FeNO no se vieron afectados; por el contrario, el dupilumab, un anticuerpo monoclonal anti-IL-4Rα que bloquea la señalización de IL-4 e IL-13, y el lebrikizumab, un anticuerpo monoclonal anti-IL-13, redujeron significativamente los niveles de FeNO desde el inicio, mientras que las concentraciones de eosinófilos en sangre periférica están aumentadas transitoriamente o marginalmente, respectivamente.13-14
Los autores destacan como principal limitación que se trata de un análisis post-hoc y, como tal, está inherentemente sujeto al sesgo potencial de elección de análisis una vez que los datos están disponibles y, por ello, concluyen que es conveniente que estos análisis de subgrupos post-hoc se confirmen en estudios futuros.
En conclusión, estos trabajos muestran que, en el asma no controlada de moderada a grave, los niveles basales más altos de FeNO se asociaron con un mayor riesgo de exacerbaciones graves del asma, especialmente en combinación con un recuento elevado de eosinófilos y exacerbaciones. Todo ello refuerza el potencial añadido de FeNO como biomarcador pronóstico.
Respecto al interesante artículo comentado en esta revisión,15 este presenta como objetivo principal la propuesta de una escala de riesgo que puede predecir las crisis asmáticas y que esté basada en el recuento de eosinófilos en sangre y el FeNO para, de esta forma, prevenirlos mediante tratamiento.
Los autores diseñaron un prototipo de escala de riesgo basada en la extracción de las tasas de crisis asmáticas estratificadas y agrupadas por biomarcadores de diversos ensayos (los ensayos utilizados fueron Novel START, CAPTAIN, QUEST, Benralizumab Fase 2b, PATHWAY, STRATOS 1–2 y DREAM), con una n total de 3.051, con la intención de demostrar el potencial para predecir las crisis asmáticas.
Los resultados se muestran directamente en el prototipo de la escala de riesgo resultante (Figura 1), en que cada celda representa la tasa anual de crisis asmática prevista para un escenario dado, si no se cambia el tratamiento. Estas tasas varían de 0,06 a 2,60 por año.
Una característica importante del prototipo de la escala de riesgo es que centra la atención en los biomarcadores que no sólo están estrechamente asociados con el mecanismo de las crisis asmáticas, sino que también se modifican fácilmente con la terapia dirigida contra este mecanismo. Por ejemplo, el exceso de riesgo de crisis asmáticas asociado con la combinación de biomarcadores más alta en comparación con la más baja se eliminó eficazmente con corticosteroides inhalados (ICS) en dosis bajas en el asma leve, una dosis mayor de ICS en el asma moderada y con terapias biológicas en el asma grave. Además, en muchos casos esta reducción del riesgo se asocia con una reducción proporcional de los biomarcadores.
Los autores reconocen las limitaciones de la escala, entre las que destacan el desconocimiento del riesgo independiente conferido a los diversos factores de riesgo categorizados y asociados con los biomarcadores de tipo 2, la existencia de covariables no ajustadas perfectamente entre sí o que el prototipo presente categorías en lugar de valores absolutos de eosinófilos en sangre, FeNO y factores de riesgo clínicos, por lo que aceptan la posible existencia de mejores formas de representación del riesgo continuo asociado con estos factores. Pero finalmente, concluyen que la escala de riesgo basada en este prototipo podría facilitar mejores decisiones de tratamiento por parte de médicos y pacientes al proporcionar un marco para una gestión preventiva, tratable y basada en rasgos, aunque dicha hipótesis debe probarse, además de que la escala debe mejorarse mediante la utilización de datos de pacientes individuales de poblaciones grandes y bien caracterizadas.
Figura 1. Prototipo de escala de riesgo de crisis asmática
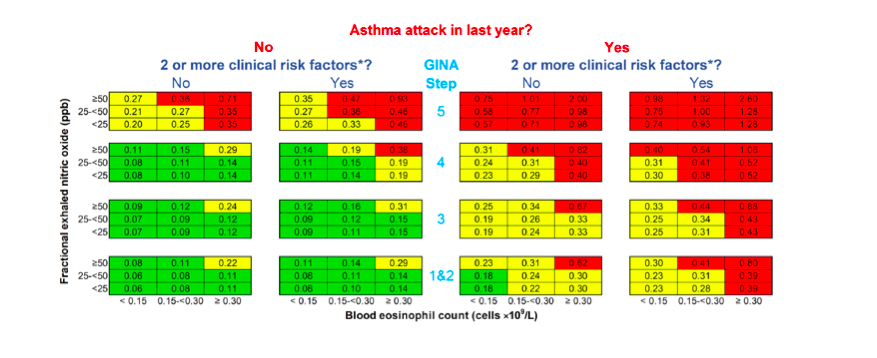 Los números en cada celda son tasas de crisis asmáticas anuales previstas para pacientes mayores de 12 años si no se cambia el tratamiento. La crisis asmática se define como un episodio de asma aguda que requiere tratamiento con esteroides sistémicos ≥3 días y/u hospitalización.
Los números en cada celda son tasas de crisis asmáticas anuales previstas para pacientes mayores de 12 años si no se cambia el tratamiento. La crisis asmática se define como un episodio de asma aguda que requiere tratamiento con esteroides sistémicos ≥3 días y/u hospitalización.
El recuento de eosinófilos en sangre es actual o el resultado más alto de los últimos 12 meses; la medida del FeNO, la actual.
*Los factores de riesgo están definidos por las directrices de la Global Initiative for Asthma (GINA) 2021:16 control deficiente de los síntomas (puntuación ≥1,5 en el cuestionario de control del asma), función pulmonar baja (volumen espiratorio forzado en 1 segundo <80% previsto), problemas de adherencia, uso excesivo del tratamiento sintomático de rescate (>200 dosis de salbutamol/mes), intubación o ingreso a la unidad de cuidados intensivos por asma previamente, comorbilidades (una de rinosinusitis crónica, obesidad y enfermedad psiquiátrica) y exposiciones ambientales (una de tabaquismo, alérgenos y contaminación).
Comentario
A pesar de que se necesitan más estudios prospectivos cuyo objetivo principal sea demostrar los hallazgos que se han comentado, parece claro que tanto el FeNO como la eosinofilia en sangre periférica son biomarcadores muy útiles en el seguimiento del asma bronquial y pueden ser un buen indicador de pronóstico del riesgo futuro de exacerbaciones graves, así como de la respuesta al tratamiento. Una propuesta muy interesante sería la utilización de una escala de riesgo que pueda predecir las posibilidades de padecer una crisis asmática para poder tratarla, en la que tendrían mucho valor tanto los eosinófilos en sangre como el FeNO.
Bibliografía
- Hoyte FCL, Gross LM, Katial RK. Exhaled nitric oxide: an update. Immunol Allergy Clin North Am. 2018; 38:573-585.
- Donohue JF, Jain N. Exhaled nitric oxide to predict corticosteroid responsiveness and reduce asthma exacerbation rates. Respir Med. 2013;107:943-952.
- Dweik RA, Boggs PB, Erzurum SC, et al. American Thoracic Society Committee on interpretation of exhaled nitric oxide levels (FENO) for clinical applications. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med. 2011;184:602-615.
- Busse WW, Wenzel SE, Casale TB, FitzGerald JM, Rice MS, Daizadeh N, Deniz Y, Patel N, Harel S, Rowe PJ, Graham NMH, O’Riordan T, Pavord ID. Baseline FeNO as a prognostic biomarker for subsequent severe asthma exacerbations in patients with uncontrolled, moderate-to-severe asthma receiving placebo in the LIBERTY ASTHMA QUEST study: a post-hoc analysis. Lancet Respir Med. 2021;9:1165-1173. Publicado en línea. 25 de junio de 2021. https://doi.org/10.1016/ S2213-2600(21)00124-7.
- Mansur AH, Srivastava S, Sahal A. Disconnect of type 2 biomarkers in severe asthma; dominated by FeNO as a predictor of exacerbations and periostin as predictor of reduced lung function. Respir Med. 2018;143:31-38.
- Lehtimäki L, Csonka P, Mäkinen E, Isojärvi J, Hovi SL, Ahovuo-Saloranta A. Predictive value of exhaled nitric oxide in the management of asthma: a systematic review. Eur Respir J. 2016;48:706-714.
- Pavord ID, Korn S, Howarth P, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet. 2012;380:651-659.
- Zeitkowski Z, Bodenzenta-Lutaszyk A, Tomasiak MM, et al. Comparison of exhaled nitric oxide measurement with conventional tests in steroid-naïve asthma patients. J Investig Allergol Clin Immunol. 2006;16:239-246.
- Global Initiative for Asthma (GINA). Pocket guide for asthma management and prevention (for adults and children older than 5 years). Fontana, WI: GINA, 2015.
- Cowan DC, Taylor DR, Peterson LE, et al. Biomarker-based asthma phenotypes of corticosteroid response. J Allergy Clin Immunol. 2015; b135: 877-883.
- Stokes JR, Casale TB. Characterization of asthma endotypes: implications for therapy. Ann Allergy Asthma Immunol. 2016; b117:121-125.
- Heaney LG, Djukanovic R, Woodcock A, et al. Research in progress: Medical Research Council United Kingdom Refractory Asthma Stratification Programme (RASP-UK). 2016;71:187-189.
- Corren J, Lemanske RF, Hanania NA, et al. Lebrikizumab treatment in adults with asthma. N Engl J Med. 2011;365:1088-1098.
- Castro M, Corren J, Pavord ID, et al. Dupilumab efficacy and safety in moderate-to-severe uncontrolled asthma. N Engl J Med. 2018;378:2486-2496.
- Couillard S, Laugerud A, Jabeen M, Ramakrishnan S, Melhorn J, Hinks T, Pavord I. Derivation of a prototype asthma attack risk scale centred on blood eosinophils and exhaled nitric oxide. 2021;0:1-4, doi:10.1136/thoraxjnl-2021-217325.
- Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention (2021 update), 2021. Disponibe en: https://ginasthma.org/.







