Results of a Phase 2b Trial with GB001, a Prostaglandin D2 receptor 2 Antagonist, in Moderate to Severe Eosinophilic Asthma
Autores: Moss MH, Lugogo NL, Castro M, Hanania NA, Ludwig-Sengpiel A, Saralaya D, et al.
Referencia: Chest. 2022;162(2):297-308.
Revisor: Marta Ferrer Galván. Servicio de Neumología. Hospital Universitario Virgen del Rocío. Sevilla
Palabras clave: asma eosinofílica moderada-grave, antagonista del receptor 2 de prostaglandina D2
Resumen
Los pacientes con asma grave mal controlada presentan niveles de prostaglandina D2(PGD2) elevados. El antagonista del receptor de la prostaglandina D2(DP2) inhibe la acción de esta, lo que incluye el reclutamiento y la activación de las células implicadas en la patogénesis del asma. Para valorar el efecto del antagonista PGD2, el GB001, en pacientes con asma eosinofílica moderada-grave mal controlada se plantea este estudio multicéntrico fase 2b.
Se trata de un ensayo doble ciego randomizado en el que se añadió al tratamiento estándar el fármaco de estudio GB001 o placebo. Se incluyeron pacientes con asma moderada-grave con un recuento de eosinófilos ≥250 células/µL, en tratamiento con corticoides inhalados a dosis media-alta o en combinación, pero sin corticoides orales, con ≥2 exacerbaciones en el año previo o 1 exacerbación y con un Asthma Control Questionnaire-5 (ACQ-5) ≥1,5 en el año previo. Se excluyó a los pacientes con enfermedad metabólica, hepática o enfermedad autoinmune. Los pacientes se aleatorizaron a uno de los 4 tratamientos (GB001 20 mg, 40 mg, 60 mg o placebo) una vez al día, vía oral. La duración del tratamiento fue de 24 semanas y se hizo un seguimiento de 4 semanas más.
Como objetivo primario, se tomó la proporción de pacientes que tuvieron empeoramiento del asma definida por alguno de los siguientes: 2 días consecutivos con PEF ≤ 75% de media; FEV1 <80 % del basal; aumento en la medicación de rescate de ≥6 puff al día durante 2 días consecutivos; aumento del ACQ-5 de ≥0,5; o exacerbación grave. Como objetivos secundarios: tiempo hasta empeoramiento del asma, número de exacerbaciones de asma graves al año, cambios del FEV1 pre broncodilatador, puntuación de ACQ-5 y PEF a las 24 semanas del tratamiento.
De los 999 pacientes que cumplieron criterios, se aleatorizó finalmente a 480, siendo excluidos 519 por fallo de screening o por no completar la inclusión, quedando distribuidos de la siguiente forma: GB001 20 mg (n=120), GB001 40 mg (n=118), GB001 60 mg (n=122) o placebo (n=120). Las características basales eran similares en los 4 grupos. El 11,7 % abandonaron el tratamiento, con un porcentaje mayor en los grupos de tratamiento de 60 y 40 mg.
En cuanto a los resultados, todos los grupos de tratamiento mostraron una reducción de la proporción de pacientes con episodios de empeoramiento del asma frente a placebo, en el seguimiento a 24 semanas, aunque sin llegar a alcanzar una significación estadística (OR, 0,674 [I.C. 95%, 0,398-1,142]; OR, 0,677 [I.C. 95%, 0,399-1,149]; y OR, 0,651 [I.C. 95%, 0,385-1,100] (Figura 1). No hubo diferencias en el efecto del tratamiento de ambos grupos cuando se realizó un subanálisis en relación con los niveles de eosinófilos y/o los valores del FENO. Estos resultados coinciden con los del reciente ensayo fase 3, LUSTER-1 y LUSTER-2, con fevipiprant (otro antagonista oral DP2), en el que se incluyó a pacientes con asma moderada-grave.
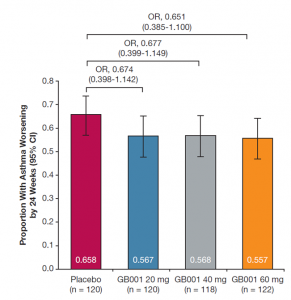
Figura 1. Objetivo principal: Proporción de pacientes con episodios de empeoramiento a las 24 semanas de tratamiento con GB001.
En cuanto a los objetivos secundarios, se produjo una reducción del número de exacerbaciones graves anuales respecto a placebo, aunque sin significación estadística (RR, 0,797 [95% CI, 0,501-1,268]; RR, 0,748 [95% CI, 0,469-1,195]), y RR, 0,889 [95% CI, 0,565-1,397]. El resto de objetivos secundarios, incluidos los cambios a las 24 semanas del FEV1 prebroncodilatador, PEF y la puntuación ACQ-5, mostraron una mejoría numérica modesta que no alcanzó tampoco la significación estadística.
La incidencia de eventos adversos fue similar en los 4 grupos de tratamiento. Los más frecuentes, con una mayor incidencia en el grupo de tratamiento GB001 que en el grupo placebo, fueron nasofaringitis, dolor de cabeza, sinusitis y aumento de enzimas hepáticas. Una proporción alta de pacientes con GB001 a dosis alta (60 mg) abandonaron el tratamiento.
Comentario
Aunque hoy día se dispone de tratamientos biológicos para pacientes con asma grave mal controlada, el tratamiento con los antagonistas de DP2 supondría una alternativa no biológica para los pacientes en que persista mal control. El GB001 es un potente y altamente selectivo antagonista de DP2 oral que se une reversiblemente al receptor PGD2 con una tasa de disociación lenta. Presenta como ventajas su administración oral. Además, en estudios farmacocinéticos previos se ha observado que la absorción del GB001 es rápida, pues alcanza el pico máximo a las 3 horas y estado estacionario en el día 4 de tratamiento, lo que lo hace adecuado para la dosificación una vez al día. Hasta la fecha, los resultados de eficacia han sido discretos, siendo el grupo con fenotipo 2 (eosinófilos en sangre ≥300 células/µL y/o FENO elevado) el que mejor resultados presenta. Respecto a estudios previos con GB001, la aportación de este ensayo consiste en incluir a una población con asma moderada-grave, grupos de tratamiento con dosis más alta, estudio de otros eventos que marcan empeoramiento del asma y seguimiento a 6 meses.
Los resultados del presente estudio –estudio LEDA– sugieren que, independientemente de los marcadores de inflamación tipo 2, los pacientes en tratamiento con GB001 se pueden beneficiar de un tratamiento oral no biológico añadido al tratamiento habitual para mejorar los episodios de empeoramiento del asma. El perfil de seguridad es aceptable, salvo las dosis de 60 mg de GB001 por el riesgo de hepatotoxicidad.







