Título
Effect of tezepelumab on airway inflammatory cells, remodelling, and hyperresponsiveness in patients with moderate-to-severe uncontrolled asthma (CASCADE): a double-blind, randomised, placebo-controlled, phase 2 trial
Autores
Diver S, Khalfaoui L, Emson C, Wenzel SE, Menzies-Gow A, Wechsler ME, Johnston J, Molfino N, Parnes JR, Megally A, Colice G, Brightling CE, on behalf of the CASCADE study investigators.
Referencia
Lancet Respir Med. 2021;9:1299-1312. https://doi.org/10.1016/S2213-2600(21)00226-5
Revisor
Francisco Javier Callejas González
Servicio de Neumología. Complejo Hospitalario Universitario de Albacete (CHUA).
Tema
Efecto del tezepelumab sobre las células inflamatorias de las vías respiratorias, la remodelación y la hiperreactividad en pacientes con asma no controlada de moderada a grave
Palabras clave
Tezepelumab, células inflamatorias, remodelación, hiperreactividad, asma
Resumen
Los pacientes con asma grave no controlada presentan una inflamación persistente de las vías respiratorias que de forma progresiva puede acabar produciendo todo tipo de cambios estructurales tanto en la vía pequeña como en la vía grande, hasta llegar a provocar una remodelación de las vías respiratorias y, como consecuencia, una obstrucción al flujo aéreo. El control de dicha inflamación con corticoides inhalados puede mejorar la situación clínica de la mayor parte de estos pacientes, pero existe un subgrupo de los mismos (aproximadamente el 10 %)1 que tiene una respuesta incompleta, con síntomas y exacerbaciones a pesar del tratamiento con la terapia de control estándar a dosis altas. En estos pacientes se ha demostrado la importancia de las terapias biológicas como tratamientos adyuvantes. Actualmente, la mayor parte de las terapias biológicas están destinadas a IgE o citocinas tipo 2 (T2) (interleucina-4, 5 y 13)1 y sus receptores mejoran el control de la enfermedad en muchos pacientes con fenotipos específicos de asma grave (como los eosinofílicos o alérgicos). Sin embargo, los agentes biológicos actuales no son los idóneos para otro subgrupo de pacientes con asma grave, en particular aquellos con fenotipos no alérgicos o no eosinofílicos.2,3
La linfopoyetina estromal tímica (TSLP) es una citocina derivada de células epiteliales implicada en múltiples procesos presentes en la fisiopatología del asma.4 En los pacientes asmáticos, los niveles de TSLP se correlacionan con la obstrucción de las vías respiratorias, la gravedad de la enfermedad y la resistencia a los glucocorticoides,5 puesto que se ha demostrado que está implicada en el inicio y la persistencia de la inflamación de las vías respiratorias. La TSLP activa múltiples tipos de células y vías inflamatorias implicadas en la fisiopatología del asma, tanto mediada por T2 como no T2.5 Se ha demostrado que la TSLP se libera del epitelio en respuesta a las agresiones epiteliales inhaladas (alérgenos, virus y bacterias) y activa varias células inflamatorias que favorecen la inflamación T2 mediante la regulación de las células dendríticas, células linfoides innatas del grupo 2 y mastocitos.6 Además, se ha descubierto que contribuye a la remodelación de las vías respiratorias mediante el aumento de la producción de colágeno por parte de los fibroblastos y la proliferación del músculo liso de las vías respiratorias.7 También hay estudios in vitro que han revelado que regula aspectos específicos de la inflamación neutrofílica.5
El tezepelumab es un anticuerpo monoclonal humano (IgG2λ) que se une específicamente a la TSLP evitando que interactúe con su receptor heterodimérico.8 Se ha demostrado que reduce niveles de biomarcadores T2, eosinófilos en sangre, IgE total en suero y óxido nítrico exhalado (FeNO).1 También se había observado previamente que disminuye los eosinófilos en el esputo y la hiperreactividad de las vías respiratorias a la metacolina y además atenúa la respuesta a los alérgenos inhalados.8 En el ensayo de fase 2b PATHWAY, la tasa anualizada de exacerbaciones de asma fue un 71 % más baja con tezepelumab que con placebo y que el número de exacerbaciones se redujo independientemente de los niveles iniciales de biomarcadores inflamatorios, incluida la fracción de óxido nítrico exhalado [FeNO], eosinófilos e IgE en sangre y el estado alérgico.9-11
Este artículo presenta los resultados del estudio de fase 2 CASCADE, que se realizó para explorar el mecanismo de acción del tezepelumab en pacientes con asma no controlada de moderada a grave.
CASCADE fue un estudio de fase 2, exploratorio, doble ciego, aleatorizado, controlado con placebo y de grupos paralelos realizado en 27 centros de Canadá, Dinamarca, Alemania, Reino Unido y Estados Unidos. Se asignó aleatoriamente (1:1) a adultos de 18 a 75 años de edad con asma no controlada de moderada a grave para recibir 210 mg de tezepelumab o placebo. El fármaco se administró por vía subcutánea cada 4 semanas durante 28 semanas, que se ampliaron hasta 52 semanas en caso de COVID-19. La aleatorización fue contabilizada y estratificada por el recuento de eosinófilos en sangre.
Por medio de biopsia broncoscópica se evaluó por separado el número de células inflamatorias de la submucosa de las vías respiratorias (eosinófilos, neutrófilos, células T CD3+, células T CD4+, mastocitos triptasa+ y mastocitos quimasa+). También se recopilaron los niveles basales de biomarcadores inflamatorios de tipo 2, incluido el recuento de eosinófilos en sangre. La remodelación de las vías respiratorias se valoró por medio de los cambios del grosor de la membrana basal reticular y la integridad epitelial (proporciones de epitelio denudado, dañado e intacto). También se estudió la hiperreactividad de las vías respiratorias al manitol.
Entre el 2 de noviembre de 2018 y el 16 de noviembre de 2020, se inscribió a 250 pacientes, tal y como muestra la figura 1. Finalmente, completaron el estudio y fueron evaluados los resultados de 48 pacientes de los tratados con tezepelumab y de 51 pacientes tratados con placebo.
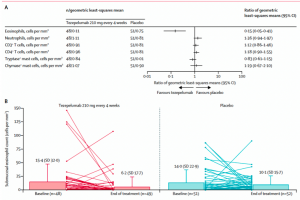
El tratamiento con tezepelumab reveló una significativa reducción desde el inicio del estudio hasta el final del tratamiento en los eosinófilos submucosos de las vías respiratorias en comparación con el placebo (reducción del 89 % con tezepelumab y del 25 % con placebo). Sin embargo, no hubo diferencias significativas entre ambos grupos de tratamiento con respecto a otro tipo de células inflamatorias (neutrófilos, células T CD3+, células T CD4+, mastocitos triptasa+ ni mastocitos quimasa+) (Figura 2).
Figura 1. Perfil del ensayo.
Figura 2. Cambio desde el inicio hasta el final del tratamiento de las células inflamatorias de la submucosa de las vías respiratorias. (A) Relación de cambio desde el inicio hasta el final del tratamiento. La línea vertical no representa diferencia entre tratamientos. (B) Media aritmética de eosinófilos absolutos al inicio y al final del tratamiento.
En lo que respecta a la remodelación de las vías aéreas, no hubo diferencias significativas ni en el grosor de la membrana basal reticular ni en la integridad epitelial. Por el contrario, sí se observó una reducción significativa de la hiperreactividad de las vías respiratorias al manitol en pacientes tratados con tezepelumab frente a placebo.
Los eventos adversos fueron del 90 % en ambos grupos, tanto en los pacientes en tratamiento con tezepelumab como en el grupo de placebo, sin objetivarse hallazgos de seguridad relevantes.
Los autores, tras este interesante estudio, concluyeron que el tezepelumab redujo el recuento de eosinófilos submucosos en comparación con el placebo en muestras de biopsia bronquial de pacientes con asma no controlada de moderada a grave, independientemente de los niveles de biomarcadores inflamatorios al inicio del estudio, lo que se asoció con una reducción en los biomarcadores T2, incluido el recuento de eosinófilos en sangre y FeNO y que, además, el tratamiento se asoció con una reducción de la hiperreactividad de las vías respiratorias en comparación con el placebo, lo que indica que el tezepelumab podría tener beneficios adicionales en el asma además de reducir la inflamación de las vías respiratorias T2.
Comentario
Los resultados de estos estudios en fase 2 son muy prometedores respecto a los beneficios del tezepelumab, no solamente a nivel de la reducción de la inflamación de las vías aéreas T2, sino también respecto a la reducción de la hiperreactividad de las vías respiratorias, un mecanismo con gran impacto en la clínica de nuestros pacientes asmáticos. Todo ello, además, con un adecuado perfil de seguridad. En cualquier caso, estos efectos deben mantenerse en estudios posteriores, y convendría, como ya indican los investigadores del estudio, una evaluación adicional de la función y localización de los mastocitos para obtener información sobre los mecanismos responsables de los efectos obtenidos.
Bibliografía
- Menzies-Gow A, Corren J, Bourdin A, Chupp G, Israel E, Wechsler ME, Brightling CE, Griffiths JM, Hellqvist A, Bowen K, Kaur P, Almqvist G, Ponnarambil S, Colice G. Tezepelumab in Adults and Adolescents with Severe, Uncontrolled Asthma. N Engl J Med. 2021; 384:1800-1809.
- Carr TF, Zeki AA, Kraft M. Eosinophilic and noneosinophilic asthma. Am J Respir Crit Care Med. 2018; 197:22-37.
- Hinks TSC, Levine SJ, Brusselle GG. Treatment options in type-2 low asthma. Eur Respir J. 2021;57(1):2000528.
- Shikotra A, Choy DF, Ohri CM, Doran E, Butler C, Hargadon B, Shelley M, Abbas AR, Austin CD, Jackman J, Wu LC, Heaney LG, Arron JR, Bradding P. Increased expression of immunoreactive thymic stromal lymphopoietin in patients with severe asthma. J Allergy Clin Immunol. 2012;129(1): 104.e1-111.e9.
- Gauvreau GM, Sehmi R, Ambrose CS, Griffiths JM. Thymic stromal lymphopoietin: its role and potential as a therapeutic target in asthma. Expert OpinTher Targets. 2020;24:777-792.
- Ziegler SF, Roan F, Bell BD, Stoklasek TA, Kitajima M, Han H. The biology of thymic stromal lymphopoietin (TSLP). Adv Pharmacol. 2013; 66:129-155.
- Wu J, Liu F, Zhao J, et al. Thymic stromal lymphopoietin promotes asthmatic airway remodelling in human lung fibroblast cells through STAT3 signalling pathway. 2013; 31: 496-503.
- Gauvreau GM, O’Byrne PM, Boulet L-P, Wang Y, Cockcroft D, Bigler J, Fitzerald JM, Boedigheimer M, Davis BE, Dias C, Gorski KS, Smith L, Bautista E, Comeau MR, Leigh R, Parnes JR. Effects of an anti-TSLP antibody on allergen-induced asthmatic responses. N Engl J Med. 2014;370:2102-2110.
- Corren J, Garcia Gil E, Parnes JR, Pham T-H, Griffiths JM. Tezepelumab treatment effect on annualized rate of exacerbations by baseline biomarkers in uncontrolled severe asthma patients: phase 2b PATHWAY study. Am J Respir Crit Care Med. 2019; 199:A2621, abstract.
- Corren J, Liu MC, Bowen K, Sałapa K, Colice G, Llanos-Ackert JP. Efficacy of tezepelumab in patients with low and high bronchodilator reversibility in PATHWAY. Eur Respir J. 2020;56(64):2269, abstract.
- Corren J, Ambrose C, Sałapa K, Parnes J, Colice G. Tezepelumab efficacy in severe asthma by specific allergen sensitivity: results from the PATHWAY study. Ann Allergy Asthma Immunol. 2020;125(Suppl):5-6, abstract.







