Safety and Efficacy of Dexpramipexole in Eosinophilic Asthma (EXHALE): A Randomized Controlled Trial
Revisor: Dra. Ebymar Arismendi. Servicio de Neumología, Hospital Clínic Barcelona.
Autores: Salman Siddiqui, BM, Sally E. Wenzel, Michael E. Bozik, Donald G. Archibald, MPhil, Steven I. Dworetzky, James L. Mather, Randall Killingsworth, Natasha Ghearing, Justin T. Schwartz, Sergei I. Ochkur, Elizabeth A. Jacobsen, William W. Busse, Reynold A. Panettieri, and Calman Prussin.
Referencia: Journal of Allergy and Clinical Immunology. 2023;152:1121–1130.
Palabras clave: peroxidasa eosinófila, ensayo clínico, prueba de concepto, espirometría.
Resumen
En la última década, las terapias biológicas dirigidas a la inflamación de tipo 2 han supuesto un gran avance en el tratamiento del asma grave, pero todas ellas son de administración parenteral, con todos los cuidados y costes que ello conlleva. Por lo tanto, el desarrollo de terapias orales dirigidas sería de gran interés clínico.
El dexpramipexol es el enantiómero R(+) no dopaminérgico del fármaco agonista dopaminérgico S(-) pramipexol1,2. Durante su desarrollo clínico inicial en la esclerosis lateral amiotrófica, el dexpramipexol disminuyó inesperadamente los recuentos de eosinófilos en sangre3. Además, tanto en el el síndrome hipereosinofílico como en la rinosinusitis crónica con poliposis nasal, el dexpramipexol demostró además una reducción sustancial de los eosinófilos tisulares4.
Por todo ello, se realizó el estudio EXHALE el cual es un ensayo de prueba de concepto, aleatorizado, doble ciego y controlado con placebo, para evaluar los efectos del dexpramipexol en adultos con asma moderada a grave mal controlada (escalones 3 a 5 de GINA) y contaje de eosinófilos absolutos (CEA) en sangre periférica superior o igual a 300 eosinófilos/ml, durante 12 semanas. Los sujetos fueron asignados aleatoriamente (1:1:1:1) a dexpramipexol de 37,5, 75 ó 150 mg dos veces al día o a placebo. El desenlace primario fue el cambio relativo en el CEA desde el inicio hasta la semana 12. El cambio del FEV1 prebroncodilatador en la semana 12 respecto al valor basal fue un desenlace secundario clave. También se exploró la peroxidasa eosinófila nasal. Se evaluaron un total de 103 sujetos, los cuales fueron asignados aleatoriamente a dexpramipexol dos veces al día, en dosis de 37,5 mg (n=22), 75 mg (n=26), 150 mg (n=28) o placebo (n=27).
El dexpramipexol redujo significativamente el cociente CEA corregido con placebo en la semana 12 con respecto al valor basal, tanto en el grupo de dosis de 150 mg BID (cociente, 0,23; IC del 95%, 0,12-0,43; p < 0,0001) como en el de 75 mg BID (cociente, 0,34; IC del 95%, 0,18-0,65; p 5,0014), lo que corresponde a reducciones del 77% y el 66%, respectivamente. El dexpramipexol redujo la proporción de peroxidasa eosinófila nasal en la semana 12 con respecto al valor basal en los grupos de 150 mg (mediana, 0,11; p=0,020) y 75 mg (mediana, 0,17; p=0,021). Se observaron aumentos del FEV1 corregidos con placebo a partir de la semana 4 (no significativos). El dexpramipexol mostró un perfil de seguridad favorable.
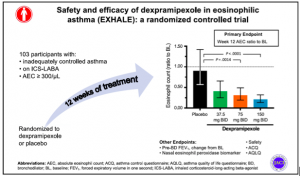
Figura 1. Resumen gráfico del estudio EXHALE.
Dentro de las limitaciones de este estudio están el tamaño de la muestra y la duración, que fueron adecuados para evaluar la reducción de eosinófilos, pero no para los criterios clínicos de la puntuación en el ACQ-6 o en el AQLQ, o funcionales del FEV1. Además, la población del estudio que se encontraba en los escalones 3 a 5 del GINA presentaba una enfermedad más leve que la incluida en los ensayos recientes de fase 3 sobre el asma y es posible que no refleje una población con asma grave.
En conclusión, el dexpramipexol demostró ser eficaz en la reducción de la eosinofilia en sangre periférica y fue bien tolerado. Dicha disminución de los eosinófilos fue dependiente de la dosis así como la mejoría del FEV1. Como fármaco oral bien tolerado, el dexpramipexol podría constituir una alternativa a las terapias biológicas actuales.
Comentario
El estudio EXHALE, es una prueba de concepto del dexpramipexol como posible tratamiento del Asma eosinofílica mal controlada, en el que se analizaron diferentes dosis del fármaco versus placebo, observando una disminución significativa del recuento de eosinófilos y mejoría de la función pulmonar en los pacientes que recibieron dosis altas del fármaco. Futuros estudios con dexpramipexol son necesarios para determinar su eficacia clínica en los pacientes con Asma eosinofílica.
Referencias
- Gribkoff VK, Bozik ME. KNS-760704 [(6R)-4,5,6,7-tetrahydro-N6-propyl-2, 6-benzothiazole-diamine dihydrochloride monohydrate] for the treatment of amyotrophic lateral sclerosis. CNS Neurosci Ther 2008;14:215-26.
- Gribkoff VK, Demady D, Ingersoll EW, Bozik ME, Frantz S. Human dopamine receptor affinity and potency in vitro and dose tolerability in beagle dogs in vivo of dexpramipexole and pramipexole. Neurology 2012;78(1 Supplement): P04.150.
- Dworetzky SI, Hebrank GT, Archibald DG, Reynolds IJ, Farwell W, Bozik ME. The targeted eosinophil-lowering effects of dexpramipexole in clinical studies. Blood Cells Mol Dis 2017;63:62-5.
Panch SR, Bozik ME, Brown T, Makiya M, Prussin C, Archibald DG, et al. Dexpramipexole as an oral steroid-sparing agent in hypereosinophilic syndromes. Blood 2018;132:501-9.
Foto de Davis Sánchez: https://www.pexels.com/es-es/foto/semaforo-negro-1727004/




