Single inhaler extrafine triple therapy in uncontrolled asthma (TRIMARAN and TRIGGER): two double-blind, parallel-group, randomised, controlled phase 3 trials
Artículo seleccionado:
Virchow JC, Kuna P, Paggiaro P, Papi A, Singh D, Corre S, Zuccaro F, Vele A, Kots M, Georges G, Petruzzelli S, Canonica GW.
The Lancet. 2019;394(10210):1737-1749. pii: S0140-6736(19)32215-9. doi: 10.1016/S0140-6736(19)32215-9. PMID: 31582314
Revisor:
Dr. Francisco Javier Callejas González. Servicio de Neumología. Complejo Hospitalario Universitario de Albacete (CHUA). Albacete
Tema: La eficacia de la triple terapia en el asma bronquial no controlada
Resumen
Hasta la fecha no disponíamos de estudios previos a este artículo que hubiesen evaluado la eficacia de la triple terapia en dispositivo único en el asma. En el caso que nos ocupa, se trata de la triple terapia en combinación extrafina de un solo inhalador con dipropionato de beclometasona (BDP), fumarato de formoterol (FF) y glicopirronio (G).
Así pues, para evaluar su eficacia se realizaron dos ensayos de fase 3 de grupo paralelo, doble ciego, aleatorizados, con control activo (triple en asma con pacientes no controlados con dosis media de ICS / LABA [TRIMARAN] y triple en asma con dosis elevadas de ICS / LABA y tiotropio [TRIGGER]) en los que se reclutaron a más de 2.500 pacientes de múltiples países (171 centros en 16 países para TRIMARAN y 221 centros en 17 países para TRIGGER). Los centros fueron de atención secundaria y terciaria y unidades especializadas de investigación, y los pacientes elegibles, adultos de 18 a 75 años con asma no controlada, con antecedentes de una o más exacerbaciones en el año anterior y tratados previamente con corticosteroides inhalados (TRIMARAN: dosis media; TRIGGER: dosis alta) más un β2 de acción prolongada agonista.
En TRIMARAN, los pacientes fueron asignados aleatoriamente (1:1) a 52 semanas de BDP / FF / G (100 μg BDP, 6 μg FF y 10 μg G) o BDP / FF (100 μg BDP y 6 μg FF), dos inhalaciones dos veces al día. En TRIGGER, los pacientes fueron asignados aleatoriamente (2: 2: 1) a 52 semanas de BDP / FF / G (200 μg BDP, 6 μg FF y 10 μg G) o BDP / FF (200 BDP y 6 μg FF), dos inhalaciones dos veces al día, o BDP / FF abierto (200 μg BDP y 6 μg FF), dos inhalaciones dos veces al día, más tiotropio 2,5 μg, dos inhalaciones una vez al día.
Los endpoints primarios para ambos ensayos (BDP / FF / G vs BDP / FF) fueron el volumen espiratorio forzado previo a la dosis en 1 segundo (FEV1) en la semana 26 y la tasa de exacerbaciones moderadas y graves durante 52 semanas. La seguridad se evaluó en todos los pacientes que recibieron al menos una dosis de tratamiento del estudio.
Respecto a los resultados, en comparación con el grupo BDP / FF, el FEV1 predosis de la semana 26, mejoraron en el grupo BDP / FF / G en 57 ml (IC 95% 15-99; p = 0,0080) en TRIMARAN y en 73 ml (26-120; p = 0,0025) en TRIGGER, con reducciones en la tasa de exacerbaciones moderadas y severas del 15% (razón de tasa 0,85, IC 95% 0,73-0,99; p = 0,033) en TRIMARAN y 12% (0,88, 0,75-1,03; p = 0,11) en TRIGGER. En cuanto a la comparación entre BDP / FF / G y BDP / FF + tiotropio, los resultados fueron similares en ambos grupos.
En cuanto a la seguridad, tres pacientes del grupo BDP / FF / G en TRIMARAN y dos pacientes en TRIGGER, uno del grupo BDP / FF / G y uno del grupo BDP / FF, sufrieron eventos adversos que condujeron a la muerte, aunque ninguna de las muertes se consideró relacionada con el tratamiento.
Por todo lo expuesto, los autores concluyen que en el asma no controlada la adición de un antagonista muscarínico de acción prolongada al corticosteroide inhalado más la terapia con agonistas β2 de acción prolongada mejora la función pulmonar y reduce las exacerbaciones.
Figura 1. Endpoints primarios. (A) Cambio de FEV1 previo a la dosis desde el inicio hasta la semana 26. (B) Tasa anual de exacerbaciones moderadas y graves. Los resultados provienen de la población por intención de tratar.
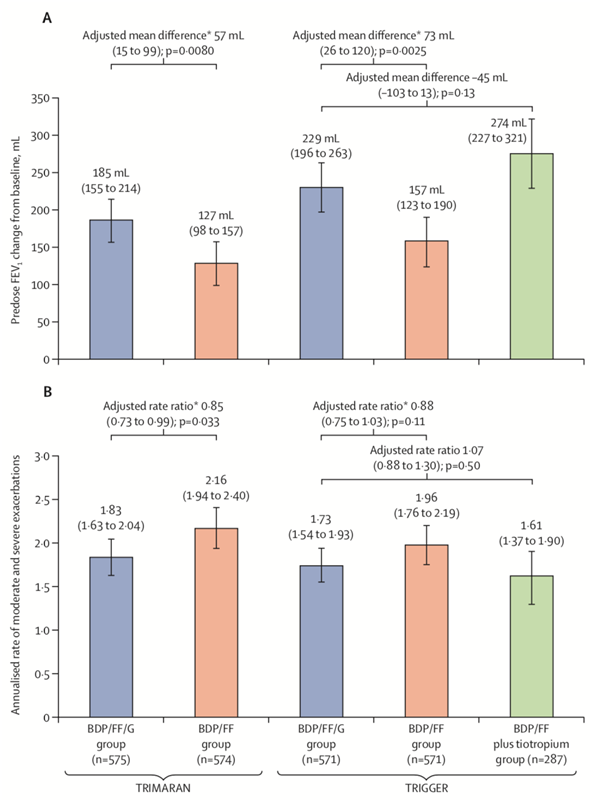
BDP = dipropionato de beclometasona. FEV1 = volumen espiratorio forzado en 1 segundo. FF = fumarato de formoterol. G = glicopirronio. TRIGGER = Triple en asma no controlada versus dosis elevadas de ICS / LABA y tiotropio. TRIMARAN = Triple en asma con pacientes no controlados versus dosis medias de ICS / LABA.
Comentario
En los últimos años se ha publicado evidencia suficiente que apoya el uso del tiotropio (antimuscarínico de acción larga (LAMA)) en dispositivo Respimat en el asma no controlada a pesar de dosis medias y/o elevadas de corticoides inhalados (ICS) asociados con B2-agonistas de acción larga (LABA), mostrando mejoras tanto en función pulmonar como en disminución de la tasa de exacerbaciones y en la gravedad de las mismas, además de en calidad de vida, y buena seguridad de uso.
Este artículo muestra que añadir a una combinación de ICS / LABA otro antimuscarínico de acción larga como el glicopirronio en un dispositivo único para una terapia triple con dosis fijas confirma los hallazgos encontrados del tiotropio. Mediante un diseño de los dos ensayos muy elaborado y un estudio estadístico adecuado, los autores concluyen que esta terapia triple en asociación muestra beneficios en función pulmonar y una disminución de exacerbaciones moderadas y graves, aunque no encuentra diferencias estadísticamente significativas en los grupos que comparaban la terapia triple fija en un único dispositivo frente a la terapia triple abierta con LABA / ICS + tiotropio. Uno de los beneficios de una triple terapia fija en comparación con la abierta podría deberse a una mejor adhesión al tratamiento, pues se disminuiría tanto el número de inhaladores que el paciente debería utilizar como el número de dosis, pero, para ello, se necesitan más estudios que confirmen los hallazgos iniciales encontrados en estos ensayos, además de otros especialmente diseñados con este último fin comentado.
Bibliografía
- Virchow JC, Kuna P, Paggiaro P, Papi A, Singh D, Corre S, Zuccaro F, Vele A, Kots M, Georges G, Petruzzelli S, Canonica GW. Single inhaler extrafine triple therapy in uncontrolled asthma (TRIMARAN and TRIGGER): two double-blind, parallel-group, randomised, controlled phase 3 trials. The Lancet. 2019;394(10210):1737-1749. pii: S0140-6736(19)32215-9. doi: 10.1016/S0140-6736(19)32215-9.PMID: 31582314.
- Kerstjens HAM, Engel M, Dahl R, et al. Tiotropium in asthma poorly controlled with standard combination therapy. N Engl J Med. 2012;367:1198-1207.
- Ohta K, Ichinose M, Tohda Y, et al. Long-term once-daily tiotropium respimat is well tolerated and maintains efficacy over 52 weeks in patients with symptomatic asthma in Japan: a randomised, placebo-controlled study. PLoS One 2015; 10: e0124109.
- Hoshino M, Ohtawa J, Akitsu K. Effects of the addition of tiotropium on airway dimensions in symptomatic asthma. Allergy Asthma Proc. 2016;37:147-153.







